学院新闻
孔炜/付毅/姜长涛团队合作发现血小板神经酰胺代谢在不影响止血和凝血作用的情况下参与调控血小板介导的炎症反应
2023年11月16日,北京大学基础医学院生理学与病理生理学系孔炜教授、付毅研究员和姜长涛教授团队合作,在《Nature Cardiovascular Research》在线发表了题为 “Alkaline Ceramidase 1-mediated Platelet Ceramide Catabolism Mitigates Vascular Inflammation and Abdominal Aortic Aneurysm Formation”的研究论文,揭示了血小板的神经酰胺代谢调控血管炎症和腹主动脉瘤的新作用机制。

血小板除了参与生理性止血和血栓形成外,还可分泌炎症因子,并与白细胞直接相互作用形成血小板-白细胞聚集体,介导炎症反应,参与多种血管炎症性疾病的发生与发展。现有的以阿司匹林为代表的抗血小板药物可同时针对血小板的止凝血功能和致炎作用,但无法进行选择性干预。由于抗血小板药物干预止凝血功能具有潜在诱导出血风险的副作用,从而限制了其以血小板为干预靶标在抗炎治疗中的应用。因此,亟需探究血小板止凝血和致炎作用调控机制的区别,发现选择性干预血小板功能的靶点,而目前我们对此知之甚少。
腹主动脉瘤(AAA)是一种高死亡率的血管疾病。目前,AAA的治疗主要依靠外科手术, 由于对AAA发病机制的了解有限,尚缺乏有效的药物治疗靶点。血小板介导的炎症反应在AAA进展过程中发挥重要作用,但抗血小板药物在AAA中的应用尚存在争议。阿司匹林可显著减缓动物模型AAA的发生发展,但因其潜在诱发出血的副作用又可能增加主动脉瘤破裂风险。如何精准干预血小板的致炎作用而不影响其止凝血功能成为靶向血小板防治腹主动脉瘤的关键。
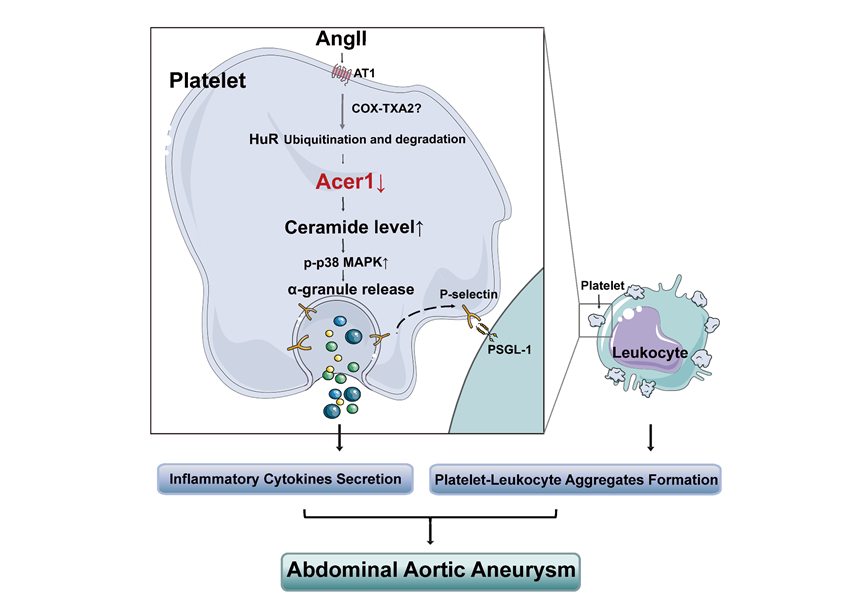
神经酰胺是由脂肪酸和鞘氨醇脱水形成的酰胺化合物。目前,神经酰胺被认为是类似胆固醇的独立心血管危险因素,严重危害人类健康。该研究通过使用靶向脂组学分析发现,在AAA小鼠和患者中,血小板神经酰胺均显著升高;进一步针对神经酰胺代谢通路中的关键酶进行筛选,发现仅有水解神经酰胺的碱性神经酰胺酶 1 (Acer1) 在AAA的血小板中显著下调且酶活性下降,而其他神经酰胺合成通路的关键酶并无显著变化。利用构建的血小板Acer1条件敲除小鼠,发现Acer1缺陷引起血小板神经酰胺蓄积,加重血管紧张素II诱导AAA的进展。机制上,Acer1缺陷引起的血小板神经酰胺蓄积显著促进血小板促炎细胞因子的分泌和P-选择素介导的血小板-白细胞聚集形成,加重血管炎症,该作用依赖于血小板p38 MAPK信号的活化。有趣的是,Acer1介导的血小板神经酰胺水解并不影响血小板参与生理性止血或血栓形成的功能。因此,血小板神经酰胺代谢可作为选择性干预血小板致炎作用的潜在靶点,可有效规避现有抗血小板药物的出血风险。
北京大学基础医学院人体生理学专业张煦博士为该论文的第一作者,北京大学基础医学院生理学与病理生理学系孔炜教授、付毅研究员和姜长涛教授为共同通讯作者。该工作还得到北京大学王宪教授、王文恭教授、雷晓光教授,北京大学附属人民医院张韬主任医师,上海交通大学医学院刘俊岭教授等的支持与帮助。该项研究获得国家自然科学基金和国家重点研发计划等经费资助。
原文链接:https://www.nature.com/articles/s44161-023-00364-1

