学院新闻
Neuron | 郑乐民联合团队发现NAD+调控血脑屏障功能新机制
2023年9月7日,北京大学血管稳态与重构全国重点实验室郑乐民教授与董尔丹教授团队,联合北京天坛医院王拥军教授团队,共同合作在Neuron杂志上发表题为“NAD+ rescues aging-induced blood-brain barrier damage via the CX43-PARP1 axis”的研究论文。该研究报告了CX43-PARP1-NAD+通路在血脑屏障相关血管细胞衰老中的重要作用,并揭示了该通路在衰老过程中保护血脑屏障功能的潜在治疗策略。

血脑屏障(blood-brain barrier,BBB)是指脑毛细血管内皮细胞、周细胞与神经胶质细胞伪足共同形成的血液与脑细胞之间的屏障,能够透过营养物质并阻止血液中的有害物质进入大脑。血脑屏障这一选择透过性结构可使脑组织免受循环血液中有害物质的损害,从而保持脑组织内环境的稳定,对维持中枢神经系统正常生理状态具有重要的生物学意义。衰老过程中血脑屏障通透性会逐步增加。血脑屏障功能紊乱与一系列的脑血管病变以及中枢神经系统疾病密切相关,包括缺血性卒中(stroke)、癫痫、阿尔茨海默症和渐冻症等。然而,衰老过程中,如何保护血脑屏障完整性,逆转后续的神经损伤,目前并不清楚。
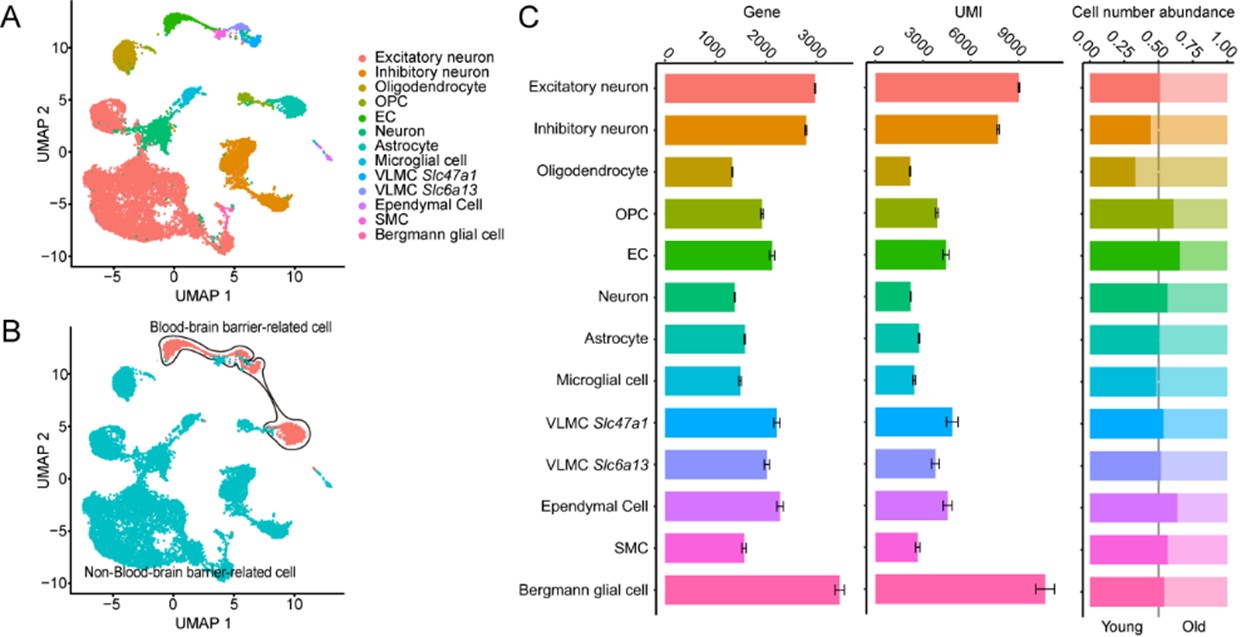
图1. 衰老脑皮层单细胞核测序及血脑屏障相关细胞亚群的划分
本研究中,作者首先通过小鼠脑皮层组织单细胞核测序,对BBB相关细胞亚群进行了划分,并对BBB相关细胞亚群进行了特征基因表达的表征,之后通过比较老年组和年轻组的差异,发现基因Gja1(gap junction 1的缩写,蛋白名为connexin 43,CX43)主要富集在BBB相关细胞亚群,并且在老年组中表达水平显著下降。作者继续使用了人脑前额叶皮层切片样本和老年小鼠脑组织切片样本对这一发现进行了验证,并且通过使用全身敲除CX43和血管Cdh5+组织特异性敲除CX43小鼠,利用活体双光子共聚焦荧光成像技术,发现了缺失CX43会进一步破坏BBB完整性。

图2.代谢组学筛选发现CX43缺失显著降低了NAD+水平
为了找到CX43影响血脑屏障功能的分子机制,作者团队对小鼠脑皮层组织进行了代谢组学筛选,发现了在敲除CX43的杂合小鼠脑皮层组织中,烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NAD+,是参与多种细胞代谢的电子受体,和参与线粒体三羧酸循环和电子传递链的脱氢酶的辅酶,在代谢过程中通过转递电子,转换为其还原形式NADH)的水平明显下降。通过活体双光子荧光寿命成像技术,验证了CX43缺失导致的脑血管相关细胞内NAD+代谢活性率的下降。
为了进一步弄清楚CX43调控NAD+水平的具体机制,对与CX43相互作用的蛋白质进行了蛋白质组学分析。首先利用免疫共沉淀的方法,获得了与CX43相互作用的蛋白质,再通过高效液相-质谱/质谱联用的方法,对与CX43相互作用的蛋白质进行了分析筛选,发现了与CX43直接作用的蛋白腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP1,EC 2.4.2.30)。PARP1是NAD+的消耗酶之一,通过消耗三磷酸腺苷(adenosine triphosphate,ATP)和NAD+,参与蛋白二磷酸腺苷(adenosine diphosphate,ADP)化修饰和DNA损伤修复。接下来本研究验证了CX43与PARP1的直接相互作用,并且发现在老年样本和CX43缺失样本中,PARP1在血管相关细胞的细胞核内表达显著上升,揭示了CX43缺失条件下,PARP1活性增强,过度消耗NAD+的这一分子机制。
最后,通过长期干预烟酰胺单核苷酸(nicotinamide mononucleotide,NMN,可经过NMN腺苷酸转移酶(NMN adenylyl-transferase,NMNAT,EC 2.7.7.1)代谢合成NAD+)或奥拉帕尼(Olaparib,PARP抑制剂,也作用于BRCA1或BRCA2突变,临床上用于治疗BRCA突变的肿瘤,比如乳腺癌,前列腺癌等)给药等方式,能够有效逆转衰老引起的血脑屏障损伤,并对缺血性卒中模型具有良好的保护作用。
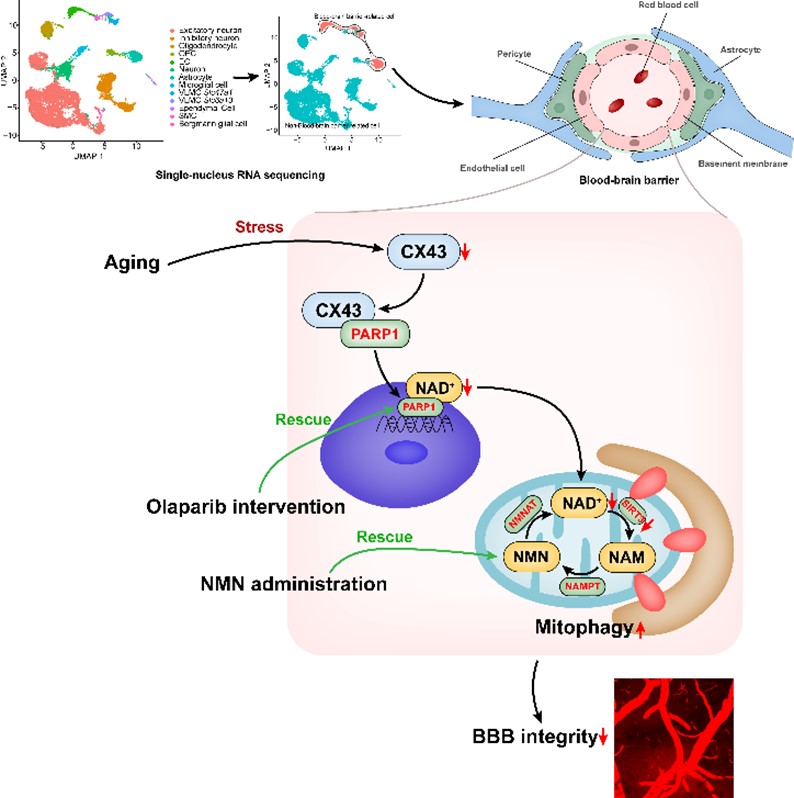
图3. CX43-PARP1轴通过调控NAD+水平逆转衰老相关血脑屏障损伤的示意图
综上,这些发现确立了内皮细胞CX43-PARP1-NAD+通路在脑血管衰老中的重要作用,提出了通过奥拉帕尼抑制PARP1活性或烟酰胺单核苷酸补充是一种潜在的治疗策略,通过缓解衰老相关的血脑屏障渗漏,以对抗衰老相关的脑血管病变和认知损伤等疾病。
郑乐民课题组已出站博士后战锐博士(现已加入康复大学(筹)进一步开展代谢调控血脑屏障功能的相关研究,北京大学-清华大学生命科学联合中心基金支持获得者)、北京天坛医院王拥军团队孟霞医生为论文的共同第一作者。北京大学心血管研究所郑乐民教授、北京天坛医院王拥军教授、北京大学心血管研究所董尔丹教授为该论文的共同通讯作者。参与作者汕头大学田东萍教授,北京天坛医院许杰博士为本文提供了重要帮助。文章同时受到了美国贝勒医学院孙正教授、美国密歇根大学陈育庆教授的大力支持与帮助。该研究工作获得了国家重点研发计划、国家自然科学基金、北京市自然科学基金等项目支持,得到了北京大学医学部-德国乌尔姆大学神经科学联合中心、北京大学血管稳态与重构全国重点实验和国家神经系统疾病临床医学研究中心脑库的大力支持和帮助。
北京大学郑乐民教授团队长期从事代谢性心脑血管疾病的相关研究,近年来在细胞代谢功能对疾病影响等方面取得了系列研究成果,提出了多个重要的心脑血管疾病干预生物靶标,为早期干预和治疗代谢紊乱致心脑血管功能失衡提供了重要的理论基础和转化前景。课题组研究主要聚焦在细胞代谢物对脑血管功能,如血脑屏障和缺血性卒中的影响(Neuron 2023,Stroke 2022,Cell Death&Dis 2018);代谢物对大血管疾病,如主动脉夹层发病的影响(European Heart J 2021,Advances Sci 2022,Cardiovasc Res 2021,STTT 2023);以及代谢对心脏与肝脏等器官代谢功能的影响(Cell Metabolism 2023,Nat Commun 2022,Kidney Int 2021)等。郑乐民教授也作为第一获奖人获得2022年北京医学科技奖一等奖。
(基础医学院)
原文链接:https://doi.org/10.1016/j.neuron.2023.08.010

