科研动态
Cell Meta|强力/汪丽恒团队揭示抗体IgG累积驱动衰老的新机制
衰老一直是科学家试图解码的生理谜题,而近日北京大学基础医学院的强力教授研究团队与汪丽恒教授团队合作,带来了一项颠覆性的发现,揭示了衰老的一个新的驱动因子:IgG,免疫系统中的主要抗体。

衰老作为慢性疾病和机体功能衰退的主要原因,一直是全球面临的最大的健康挑战之一。虽然长期以来我们知道随着年龄增长,身体的各种机能会逐渐下降,但是衰老过程的具体驱动因子一直是个谜。科学家们通过对年老和年轻老鼠的实验发现了“长寿因子”和“衰老因子”,但对于衰老的具体机制了解甚少。
以小鼠为例,衰老的表型往往在小鼠24个月龄后显著,而代谢的衰退则更早地开始发生,如胰岛素抵抗,在小鼠12个月龄(相当于人类40岁)已经显著。脂肪组织作为全身最主要的代谢器官,在衰老过程中最早、最显著地发生衰老相关基因表达变化(Cell Reports, 2020)。然而,脂肪组织的病理退化以及其背后的驱动因子和作用机制一直是个谜。
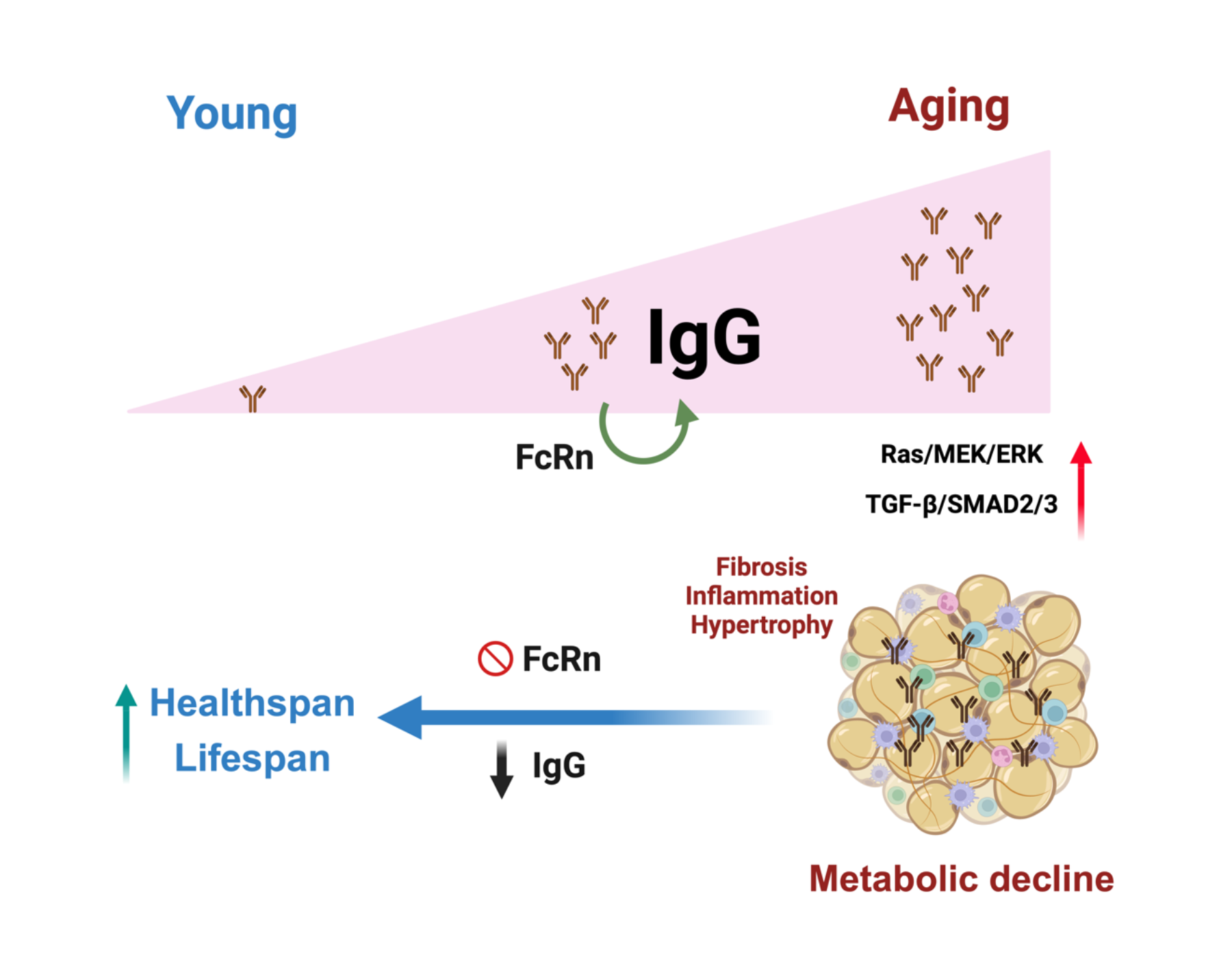
2024年2月19日,北京大学基础医学院的强力教授研究团队与汪丽恒教授团队合作,在Cell Metabolism杂志上发表了题为‘IgG is an aging factor that drives adipose tissue fibrosis and metabolic decline’ 的文章。该研究发现,IgG在衰老的早期就开始在全身累积,尤其是在脂肪组织中,并逐渐导致脂肪组织纤维化和代谢损伤。而干预IgG的累积可以显著改善衰老中的代谢衰退,延长健康寿命。
为深入理解其影响,研究人员比较年轻和衰老脂肪组织的定量蛋白组发现35-60kDa范围蛋白改变最明显,而其中显著富集的蛋白中有半数的蛋白分子是免疫球蛋白(Igs)。研究人员通过量化比较脂肪组织中免疫球蛋白发现,衰老的脂肪组织中免疫球蛋白(IgG)水平上调了近20倍。且在众多组织中,白色脂肪组织的IgG是变化最为显著的。有趣的是,研究人员采用经典的衰老改善措施限制饮食(CR)处理衰老小鼠,发现CR处理的衰老的小鼠白色脂肪组织中IgG的水平得到显著清除。而外源IgG干预处理会显著损伤CR所改善的IgG清除、脂肪组织的健康、机体胰岛素的代谢敏感性等。
研究人员还发现IgG在衰老中的具体作用机制。是通过激活巨噬细胞的炎症反应,IgG刺激后者释放TGF-β因子,诱导脂肪细胞前体细胞的纤维化,导致脂肪组织纤维化,最终损伤脂肪组织的代谢功能。研究人员通过特异性敲除巨噬细胞中的IgG循环调节受体FcRn,成功抑制了IgG在衰老过程中的积累,显著改善了脂肪组织纤维化和代谢功能,延长了健康寿命。这一发现为对抗衰老提供了新的策略,研究人员测试了IgG/FcRn作为靶点干预衰老中代谢损伤的可能性。通过FcRn的反义寡核苷酸处理衰老的小鼠,可以显著改善脂肪组织纤维化和代谢功能。
虽然IgG在体内对免疫保护至关重要,但其过度累积却可能导致脂肪组织慢性炎症、纤维化和脂肪细胞功能受损,进而引发全身代谢衰退。因此,这一研究为我们提供了一个新的观念,即免疫保护可能是通过代谢衰退来付出的代价。这也为衰老和免疫代谢研究提供了新的方向。
北京大学强力教授和汪丽恒教授为本研究的共同通讯作者。美国哥伦比亚大学于乐祥博士为本文第一作者。强力教授回国前任职于美国哥伦比亚大学,现任职北京大学基础医学院药理学系,主要从事代谢和衰老相关的机制研究和转化探索。汪丽恒教授系北京大学心血管所研究员,主要从事代谢疾病的免疫转录调控机制的相关研究。两课题组现招收博士后若干名,欢迎感兴趣的应届博士生发邮件联系。
强力教授:qiang@hsc.pku.edu.cn 汪丽恒教授:lihengwang@hsc.pku.edu.cn
撰稿:于乐翔

