科研动态
Military Medical Research杨吉春/迟毓婧团队揭示FAM3A通过PANX1调控ATP释放改善肝脏糖脂代谢的新机制
2024年6月27日,北京大学基础医学院杨吉春教授和北京大学人民医院迟毓婧副教授团队及吉林大学刘兴凯教授团队,在Military Medical Research发表“PANX1‑mediated ATP release confers FAM3A’s suppression effects on hepatic gluconeogenesis and lipogenesis”。该研究是糖尿病和非酒精性脂肪肝(NAFLD)治疗潜在靶点FAM3A的最新研究进展,揭示了PANX1介导的ATP释放是FAM3A发挥改善肝脏糖脂代谢的关键。

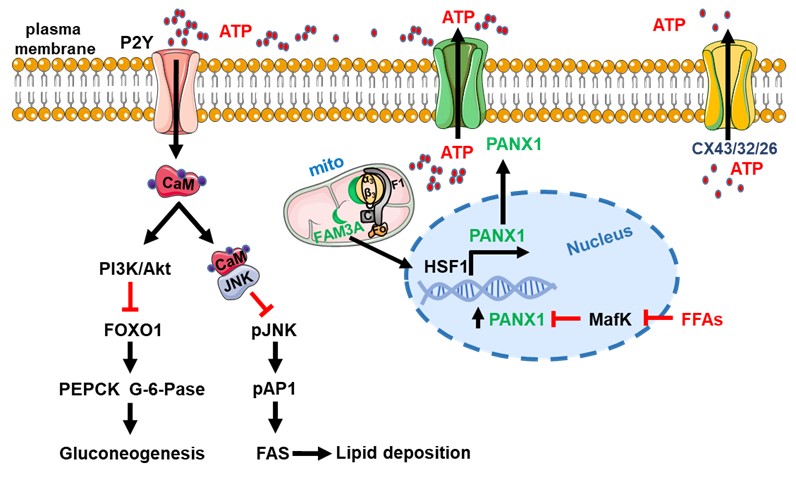
线粒体功能障碍,特别是ATP 合成减少及ROS 生成增加,在2 型糖尿病发生过程中起重要作用。ATP除了作为细胞内的重要能量分子,细胞外的ATP也是一种重要的信号分子。杨吉春教授/迟毓婧副教授团队长期从事FAM3基因家族成员在代谢性疾病中的作用研究。前期研究已经揭示FAM3A是一个线粒体蛋白,其通过促进ATP 合成和释放并作用于细胞膜上的P2 受体(以ATP 为主要配体),以非胰岛素依赖方式激活Ca2+-CaM-Akt 通路,抑制肝脏糖异生并减少脂质沉积。随后,提出了以非胰岛素依赖途径抑制肝脏糖异生的干预假说( Hepatology 2014/ Diabetes 2014/ Diabetes 2017/ Diabetes 2018/ Diabetes 2020/ Circ Res 2020/ FASEB J 2020/ Metabolism 2022/ Metabolism 2023)。系列前期研究结揭示在肝细胞、胰岛β细胞、脂肪细胞及血管平滑肌细胞中,FAM3A通过促进ATP合成释放,在细胞生理功能维持及糖脂代谢调控中起重要作用。然而,FAM3A调控ATP释放的机制仍未揭示。
团队最新的研究成果发现通道蛋白泛连接蛋白1(Pannexin 1,PANX1)在脂肪肝患者和小鼠的肝脏中表达升高,其能允许ATP通过。高脂饮食小鼠肝脏PANX1过表达后可改善小鼠的糖脂代谢失调;而敲减或者敲除肝脏PANX1表达的小鼠表现为糖脂代谢紊乱。肝脏PANX1回补改善了PANX1基因敲除小鼠的糖尿病和脂肪肝症状。进一步的机制研究发现,PANX1介导的ATP释放一方面通过激活P2Y受体-Akt-FOXO1信号通路途径抑制肝细胞糖异生,另一方面促进CaM入核与JNK相互作用抑制其活性,从而抑制AP1对脂肪酸合成酶(FAS)的转录激活作用,进而抑制肝细胞脂质沉积。研究进一步发现FAM3A通过激活热休克因子1 (HSF1)促进PANX1表达的机制,进而促进ATP释放。在体内外PANX1缺失后,FAM3A促进ATP释放、抑制肝脏糖异生和脂质沉积及改善糖脂代谢的作用丧失。该研究结果进一步夯实了非胰岛素依赖的FAM3A信号通路及网络作为代谢性疾病治疗的可行靶点,并为全面揭示FAM3A调控ATP合成释放缓解糖尿病及脂肪肝的机制提供了重要实验依据。
北京大学基础医学院生理学与病理生理学系博士研究生胡澄清和侯滔是该研究的共同第一作者。生理学与病理生理学系杨吉春教授、北京大学人民医院迟毓婧副教授和吉林大学刘兴凯教授是该研究的共同通讯作者。该研究受到国家自然科学基金杰出青年科学基金、重点项目和面上项目、北京市自然科学基金和北京大学人民医院卓越青年培育项目的资助。
原文链接:
https://mmrjournal.biomedcentral.com/articles/10.1186/s40779-024-00543-6

