科研动态
Cell Death & Disease |尹玉新/吕丹团队发现抑癌基因VHL调节尿路结石导致的肾脏炎症性损伤新机制
肾结石是继尿路感染和前列腺疾病之后的第三大泌尿科疾病,在全球范围内发病率和患病率逐年上升。据报道,大约80-90%肾结石由草酸钙(CaOx)组成的。研究发现,CaOx大量聚集和沉淀可以破坏肾小管上皮细胞的抗氧化能力,引发较强的氧化应激反应并促进上皮细胞的脂质过氧化,最终诱导上皮细胞发生铁死亡。和传统的凋亡不同,铁死亡过程中细胞可以向周围环境中释放大量的细胞内容物,即损伤相关分子模式(DAMPs),进而诱发更强的炎症反应,严重时甚至会危及结石患者的生命。由此可见,阐明肾脏炎症性损伤的调节机制对于预防及治疗肾结石相关疾病至关重要。
2023年10月13日,北大-清华生命科学联合中心、北京大学基础医学院尹玉新课题组以及吕丹课题组在Cell Death & Disease杂志上联合发表了题为Critical role of VHL/BICD2/STAT1 axis in crystal-associated kidney disease的文章,首次揭示了VHL/BICD2/STAT1信号通路在结石诱导的肾脏炎症性损伤过程中的重要作用。

Von Hippel-Lindau(VHL)作为一种重要的抑癌基因,其编码蛋白具有E3泛素连接酶的功能,可以触发缺氧诱导因子(HIFs)蛋白降解,从而限制缺氧状态下上皮细胞的生长。相反,VHL基因的突变或缺失会维持肿瘤细胞的存活并加重其恶性转化。然而,关于VHL蛋白调控肾脏炎症性损伤的研究目前尚无相关报道。
本次研究首先对比了正常肾上皮细胞和暴露于CaOx晶体的肾上皮细胞之间差异性表达的基因,发现VHL基因在CaOx处理过程中表达显著升高。为了阐明VHL基因在肾结石疾病发生发展过程中的作用,研究者首先构建了Vhl基因突变(Vhl +/mu)小鼠,并结合小鼠肾结石模型,发现Vhl基因的缺失可以提高上皮细胞对铁死亡的敏感性,加重结石介导的组织炎症性损伤。值得注意的是,这种由Vhl介导的免疫调节作用并不依赖于经典HIF信号通路。为了进一步分析VHL蛋白调控炎症反应的机制,研究者采用TurboID临近蛋白标记技术,鉴定到马车接头蛋白BICD2分子可以与VHL蛋白结合,并发现BICD2的缺失可以解除VHL对细胞铁死亡的抑制作用。分子机制研究显示,在CaOx刺激的条件下,BICD2通过促进转录因子STAT1的核转位,从而激活IFNγ信号通路,进而增强IFNγ对胱氨酸/谷氨酸反向转运体(System Xc-)亚基SLC3A2和SLC7A11的抑制效果,最终引发上皮细胞铁死亡和DAMPs的大量释放。相反,VHL蛋白通过促进BICD2的降解,抑制IFNγ信号通路的活化,进而提高上皮细胞对铁死亡的耐受能力,最终缓解组织炎症性损伤。
除了CaOx以外,研究者还发现抗肺癌药物BRAF抑制剂Vemurafenib同样可以诱导BICD2蛋白磷酸化,进而削弱了VHL与BICD2蛋白的结合,最终导致肾上皮细胞死亡和肾组织坏死。因此,本研究揭示了Vemurafenib诱导肾毒性的生物学机制,也为Vemurafenib引发的继发性肾损伤提供了新的预防方案和监测策略。
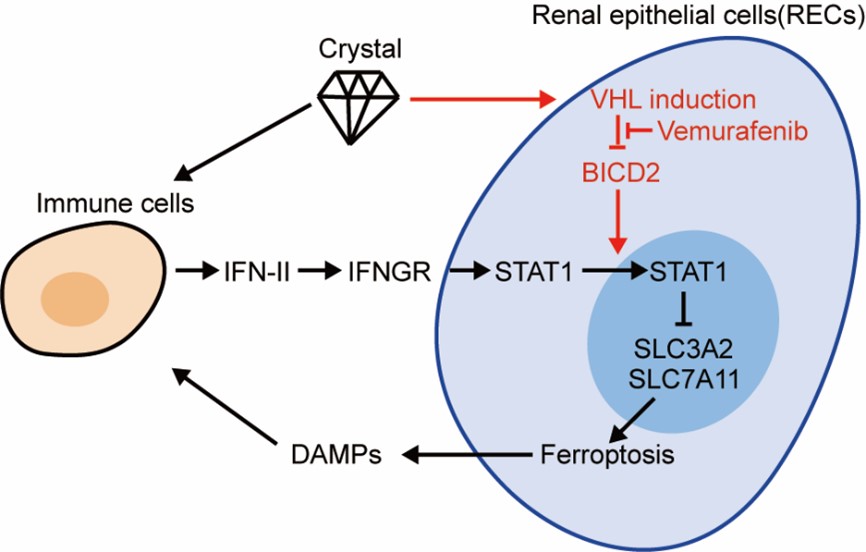
VHL/BICD2/STAT1信号通路调节CaOx结石诱导的肾损伤及其相关炎症
综上所述,本项研究揭示了VHL/BICD2/STAT1信号通路在肾脏炎症性损伤过程中的关键作用,为泌尿系结石的治疗提供了潜在的靶点,并为Vemurafenib引发的继发性肾损伤的预防提供新的方案和策略。
北京大学基础医学院博士生郝文燕为该论文的第一作者。北京大学系统生物医学研究所尹玉新教授、吕丹研究员以及北京同仁医院泌尿外科平浩主任为共同通讯作者。北京大学免疫学系邱晓彦教授、北京大学第三医院泌尿外科张洪宪主任以及北京大学系统生物医学研究所游富平教授为本研究做出了重大贡献。
原文链接:https://doi.org/10.1038/s41419-023-06185-1

