科研动态
JHO |基础医学院李扬团队和人民医院赵翔宇团队合作在诱导多能干细胞来源NK细胞肿瘤免疫治疗研究中取得重要进展
2023年6月14日,北京大学基础医学院李扬副教授和北京大学人民医院赵翔宇教授合作在Journal of Hematology & Oncology((IF="23.168))杂志在线发表题为“Leveraging CD16 Fusion Receptors to Remodel the Immune Response for Enhancing Anti-Tumor Immunotherapy in iPSC-Derived NK Cells”(利用CD16融合蛋白重塑免疫应答以增强iPSC衍生NK细胞抗肿瘤免疫疗法)的研究成果。本研究开发了一种新型hnCD16融合受体(high-affinity non-cleavableCD16 fusion receptor,hnCD16FR),该融合受体由hnCD16的胞外域、NK细胞特异性共刺激因子(2B4和DAP10)和CD3ζ构成的胞内段,它在体外和体内实验中均表现出显著增强的抗体依赖性细胞毒性,并初步揭示了该融合受体通过重塑免疫应答以增强NK细胞抗肿瘤功能的机制,并将hnCD16FR在诱导多能干细胞来源NK细胞(hnCD16FR-iPSC-NK)中进行工程化修饰,证明了hnCD16FR-iPSC-NK细胞具有良好的应用前景,可以为以NK细胞为基础的抗肿瘤免疫疗法提供新的策略和选择。

近年来,由于NK细胞相比于T细胞具有更好的治疗安全性,更多的受体激活机制,同时可以允许生产现货型的产品的特点,使得其在过继性细胞治疗领域取得了广泛的关注。目前开发出以诱导多能干细胞(induced pluripotent stem cell, iPSC)为基础的NK细胞生产方法已经可以用于临床级的规模化生产,并用于癌症的免疫治疗。当前,免疫疗法正处于从基础研究向转化医学迈进的时代,这催生了许多创新性免疫治疗策略,其中一种重要的治疗手段是通过使用治疗型抗体来诱导抗体依赖性细胞介导的细胞毒性(ADCC)来靶向肿瘤并激活NK细胞功能。
NK细胞的ADCC效应取决于在其膜表面表达的IgG受体CD16。最近的研究中开发了具有高亲和力和不可剪切特性的CD16(hnCD16),并证明了其具有对多种肿瘤的杀伤潜力。然而,hnCD16受体只能激活单一的CD16信号并提供有限的肿瘤抑制效果。由此,设计一种可以利用抗体疗法优势,并且能够靶向多种肿瘤抗原的基于hnCD16的融合信号受体,使其在保留多抗原靶向性特点的基础上,可以同时扩展抗肿瘤信号激活是进一步提高NK细胞抗肿瘤活性的一个有前景的发展方向。
在本研究中,首先利用NK细胞系在体外筛选出可以介导最有效ADCC抗肿瘤活性的融合受体结构,该融合受体由hnCD16的胞外域、NK细胞特异性共刺激因子(2B4和DAP10)和CD3ζ构成的胞内段组成(图1)。
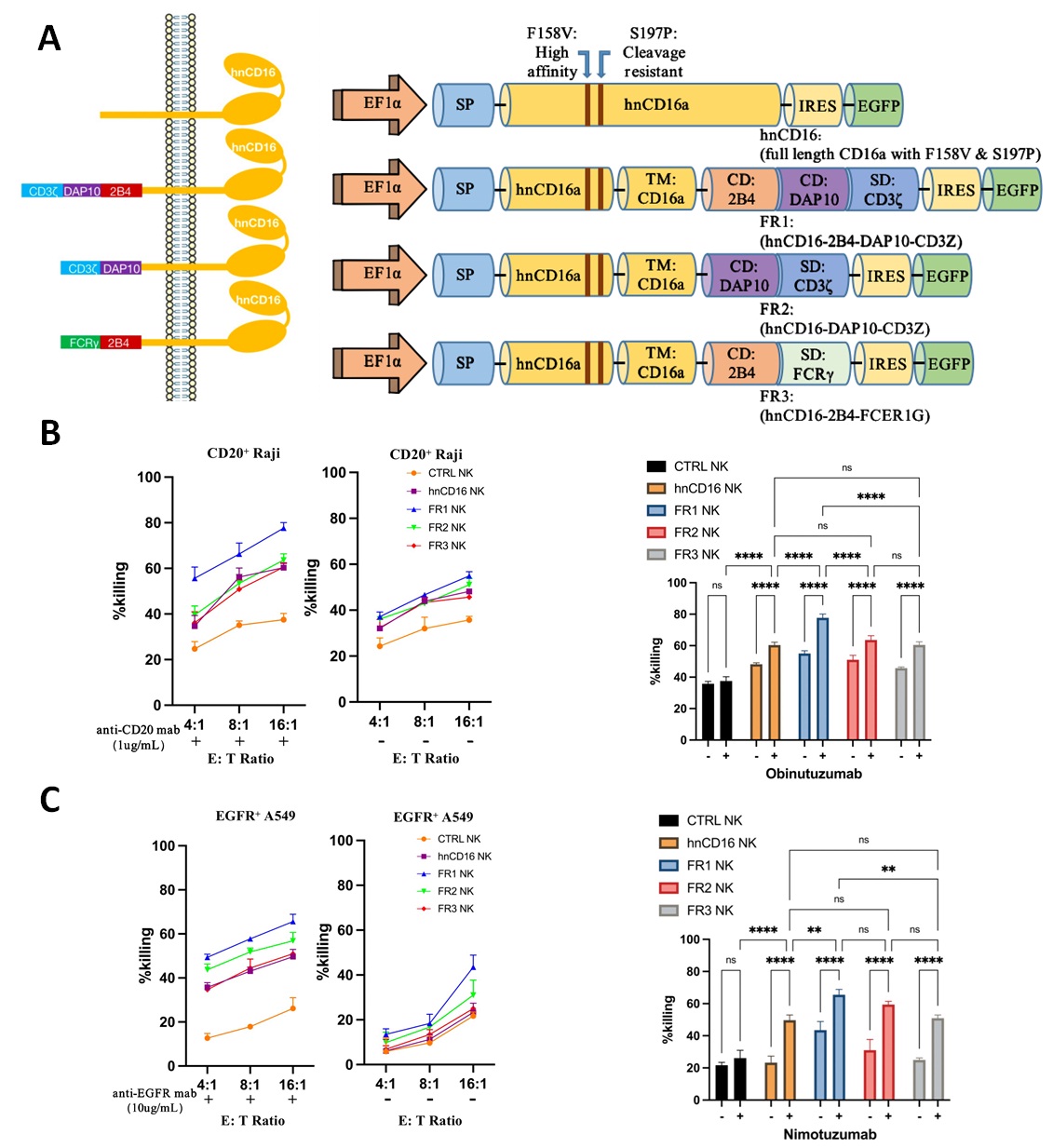
图1. 融合受体结构示意图与抗B细胞淋巴瘤、肺癌细胞杀伤效果
进一步通过转录组学分析表明,hnCD16FR的表达重塑了NK细胞中的免疫相关转录组,与hnCD16相比hnCD16FR工程化的NK细胞与细胞毒性、细胞因子产生、诱导肿瘤细胞凋亡和ADCC作用相关的基因都发生了显着上调。细胞因子释放实验证实了hnCD16FR工程化可以介导NK功能相关细胞因子的大量释放(图2)。
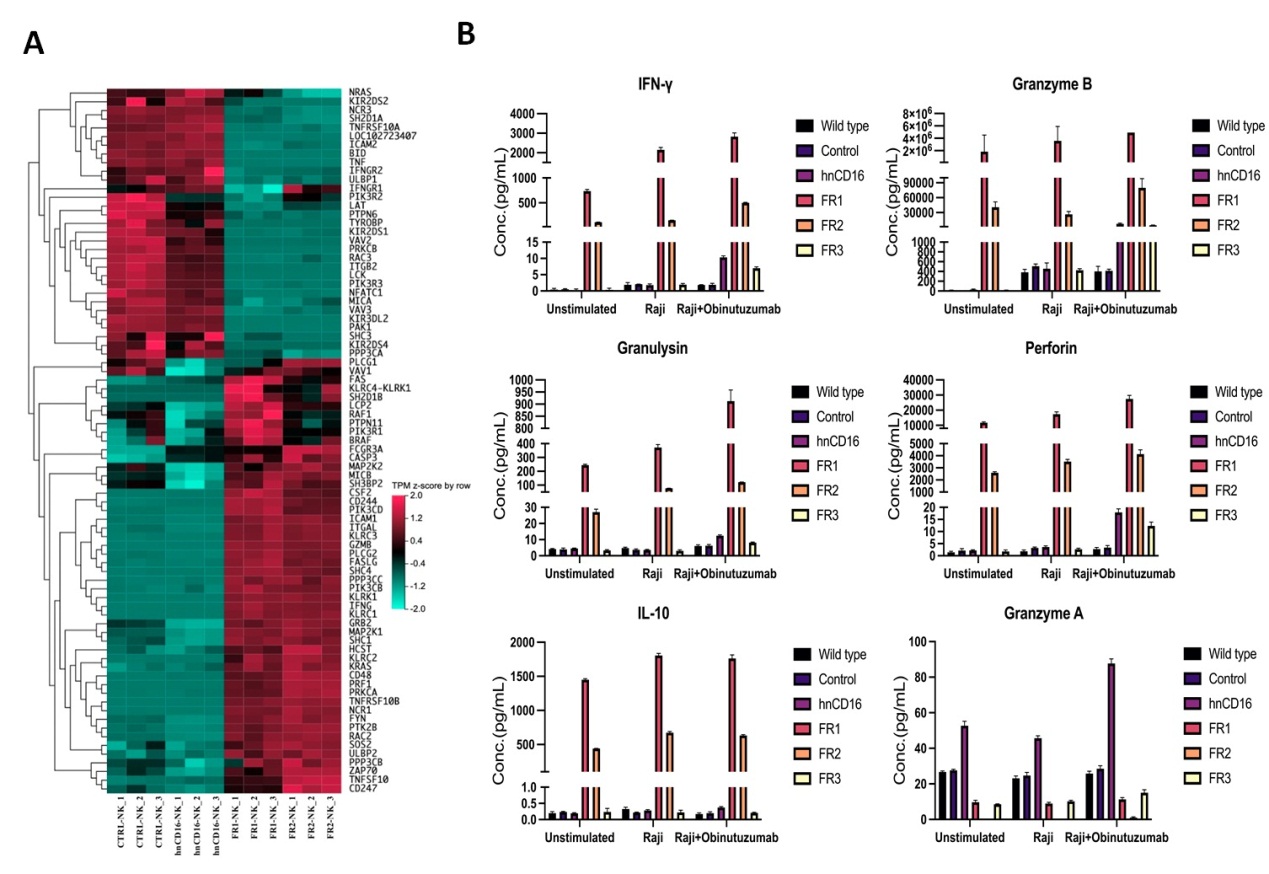
图2. hnCD16FR重塑了NK细胞中的免疫相关转录组并介导NK功能相关细胞因子的大量释放
我们将筛选出的hnCD16FR在iPSC 中进行工程化修饰,并将其分化为hnCD16FR-iNK(induced NK)细胞进行肿瘤免疫细胞治疗。与NK细胞系得到结果一致,与对照相比,hnCD16FR-iNK表现出显著的细胞因子释放和体外ADCC抗肿瘤活性(图3)。
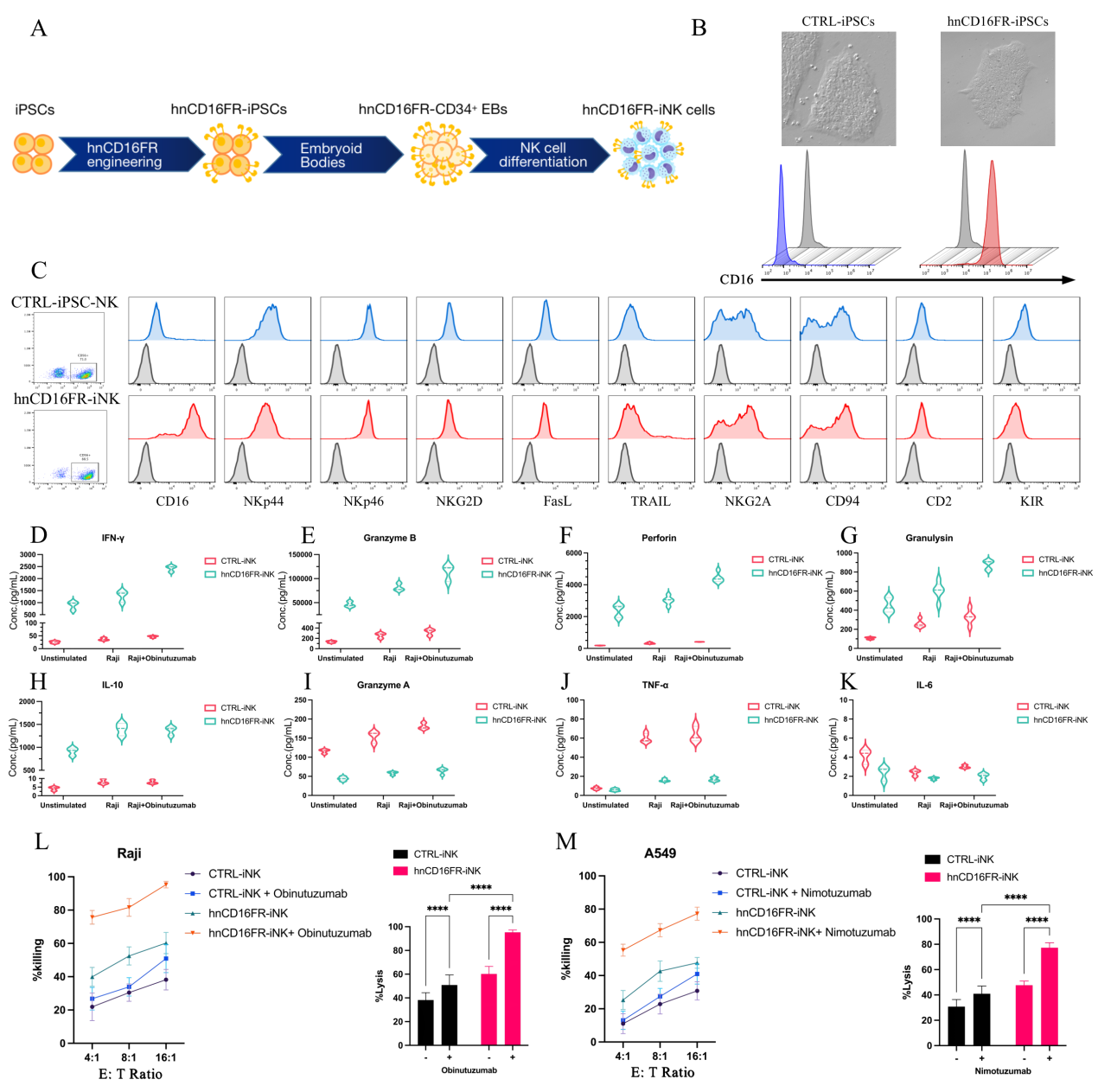
图3. hnCD16FR-iPSC其衍生NK细胞的体外抗肿瘤活性
最后,我们在小鼠B细胞淋巴瘤异种移植动物模型中进一步验证hnCD16FR-iPSC衍生NK细胞体内的ADCC抗肿瘤功能。研究结果显示,工程化修饰的hnCD16FR-iPSC衍生NK细胞的单次、低剂量注射方案与抗CD20 mAb的联合治疗策略,可以有效介导ADCC抗肿瘤活性并显着延长生存期(图4)。
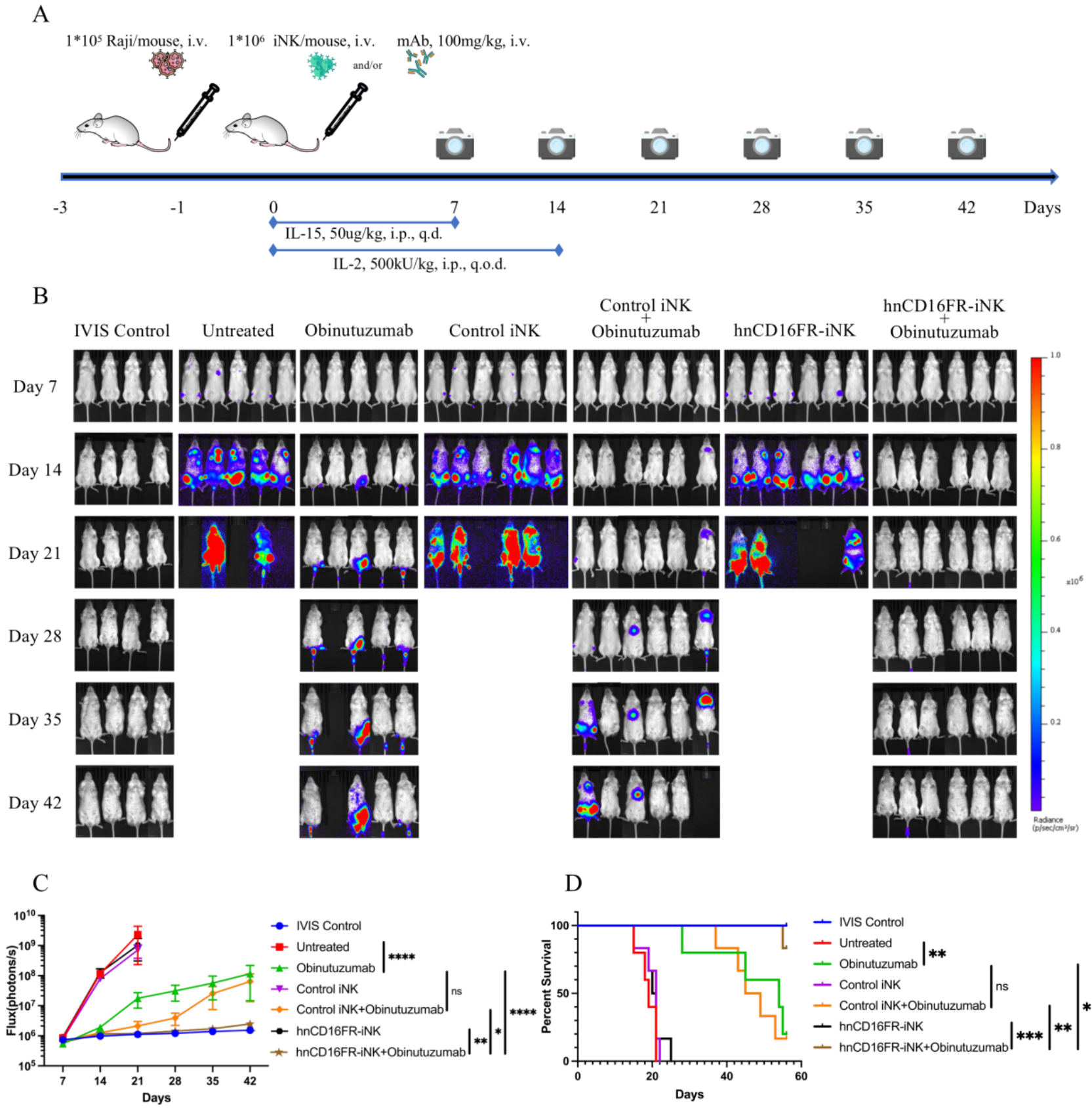
图4:在肿瘤异种移植模型中hnCD16FR-iNK细胞联合治疗的抗肿瘤效果
综上所述,本研究设计并筛选了由NK细胞激活结构域构成的hnCD16融合受体,并使用iPSC平台在体外构建了均质表达hnCD16FR的iNK细胞,这些hnCD16FR-iNK细胞可以与治疗型mAb联用以触发有效的ADCC效应并产生多种细胞因子以响应抗肿瘤免疫。同时这些经过hnCD16FR工程化的iNK细胞与抗体联合使用可以在体内介导有效的肿瘤控制。这项研究将有助于扩展iPSC-NK细胞在肿瘤免疫治疗领域的应用前景。
北京大学基础医学院硕士研究生孟繁一为该文章的第一作者,北京大学基础医学院李扬副教授、北京大学人民医院赵翔宇教授、北京大学基础医学院周士新副教授为共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金、瑞臻再生医学研究基金、北大医学交叉研究种子基金的资助。
原文链接:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-023-01455-z

