科研动态
STTT | 鲁凤民/陈香梅团队揭示宿主RNA结合蛋白TIAR调控乙型肝炎病毒复制的新机制
2023年9月13日,北京大学基础医学院、北京大学感染病研究中心鲁凤民/陈香梅研究团队在Signal Transduction and Targeted Therapy杂志在线发表题为“RNA binding protein TIAR modulates HBV replication by tipping the balance of pgRNA translation”的研究论文,发现宿主RNA结合蛋白TIAR可以调控乙型肝炎病毒(HBV)前基因组RNA(pgRNA)的选择性翻译,首次提出了HBV通过与宿主互作精细调节病毒衣壳蛋白(Cp)和聚合酶(Pol)的平衡进而确保其高效复制的新机制。

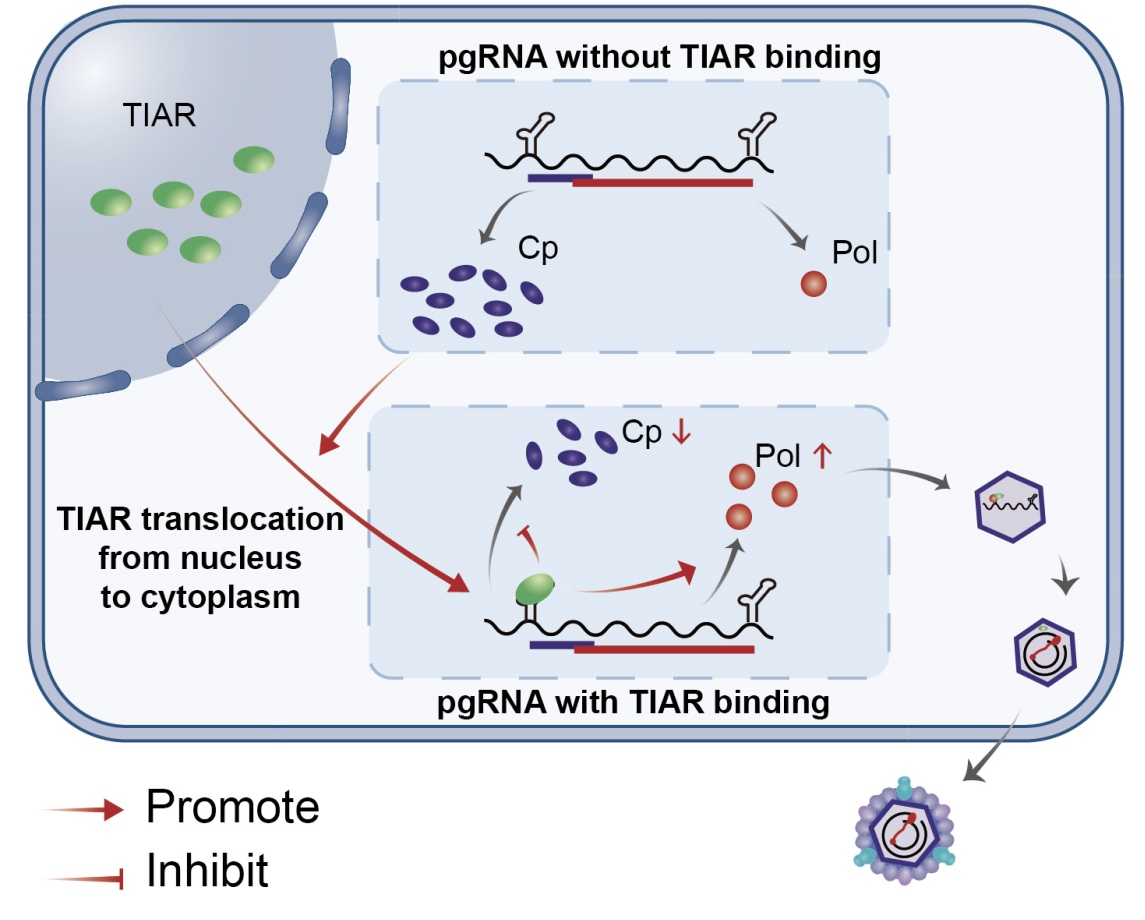
慢性HBV感染是导致肝硬化甚至肝癌的重要病因,也是全球备受关注的公共卫生问题,但现阶段尚无有效治愈手段。了解HBV复制的精细调控机制,将为研发新的抗病毒药物提供靶点和思路。HBV的pgRNA既是翻译产生Cp和Pol的双顺反子mRNA,又是逆转录形成子代病毒核酸(rcDNA)的模板。Pol形成后,可识别并结合pgRNA上的衣壳组装信号—ε茎环,启动衣壳组装并将pgRNA逆转录形成子代病毒核酸。在HBV复制过程中,pgRNA翻译产生Cp蛋白远多于Pol。由于Pol对病毒衣壳组装及逆转录至关重要,研究团队推测双顺反子pgRNA翻译产生Cp和Pol应该受到了病毒和宿主因素的精细调控。
考虑到调控pgRNA翻译的宿主蛋白更可能结合pgRNA并随之被包裹至HBV核衣壳中,该研究首先利用蔗糖密度梯度离心实验获得病毒的核衣壳,并通过蛋白质谱技术检测到49个核衣壳相关蛋白,将核衣壳相关蛋白的质谱结果与pgRNA pulldown质谱结果相交集,一共得到15个可能与pgRNA结合包入核衣壳的宿主蛋白。其中,TIA-1相关蛋白(TIA-1 related protein,TIAR)对于HBV复制的影响最为显著。但有趣的是,TIAR对Cp蛋白的表达呈抑制作用,与其上调HBV DNA水平的作用相反。鉴于Cp蛋白与Pol均翻译自pgRNA,而Pol的适量增加有利于病毒的复制,研究团队推测,TIAR可调控pgRNA双顺反子的翻译,使其更有利于Pol的翻译。由于目前尚无特异的Pol抗体,研究团队利用核糖体测序(Ribo-seq)及蛋白定量质谱技术验证了这一推测。进一步利用RNA pulldown、CLIP等技术,研究团队证实TIAR通过与pgRNA的ε茎环结合调控pgRNA的选择性翻译。
TIAR本身为核定位蛋白,但其发挥pgRNA翻译调控作用需定位在细胞质中。利用细胞免疫荧光、胞浆胞核分离技术,研究团队证实HBV复制促进了TIAR出核。而在病毒蛋白中,恰恰又是Cp蛋白可导致TIAR易位至细胞质,而其他病毒蛋白则无此作用。这一现象也在慢性HBV感染患者肝穿组织的免疫组化染色中得到了验证。
综上,该研究提出了TIAR调控HBV复制的新机制:在HBV感染肝细胞后,Cp蛋白的大量表达诱导TIAR发生胞质蓄积,胞质中的TIAR结合pgRNA并调节其选择性翻译,抑制Cp而促进Pol的翻译,从而精细调节Cp蛋白与聚Pol的平衡,这样的负反馈调节确保了HBV在肝细胞内的高效复制。这项研究对加深理解HBV生命周期及寻找HBV治疗的新靶点具有重要意义。
病原生物学系教师张婷、硕士毕业生郑惠玲(现为北京大学第三医院消化科博士生)、17级基础医学八年制博士生陆丹娟为论文的共同第一作者,北京大学基础医学院陈香梅副教授、鲁凤民教授和美国Baruch S. Blumberg研究所郭巨涛教授为论文的通讯作者。研究得到解放军第五临床中心刘树红、赵景民教授,复旦大学陈捷亮教授和厦门大学夏宁邵教授的帮助。该研究受国家自然科学基金面上项目、国家重点研发计划及北京市自然科学基金面上项目的资助。
原文链接:https://www.nature.com/articles/s41392-023-01573-7

