科研动态
The EMBO Journal |王嘉东团队与杨恩策团队合作揭示BRCA1等同源重组修复通路基因的周期表达机制与相关肿瘤靶向治疗方式
2023年6月19日,北京大学医学部王嘉东课题组与杨恩策课题组合作在The EMBO Journal上发表研究成果,揭示了BRCA1等同源重组修复通路相关基因周期表达的普遍机制,并以此为基础提出了一种新的靶向治疗联合用药策略。
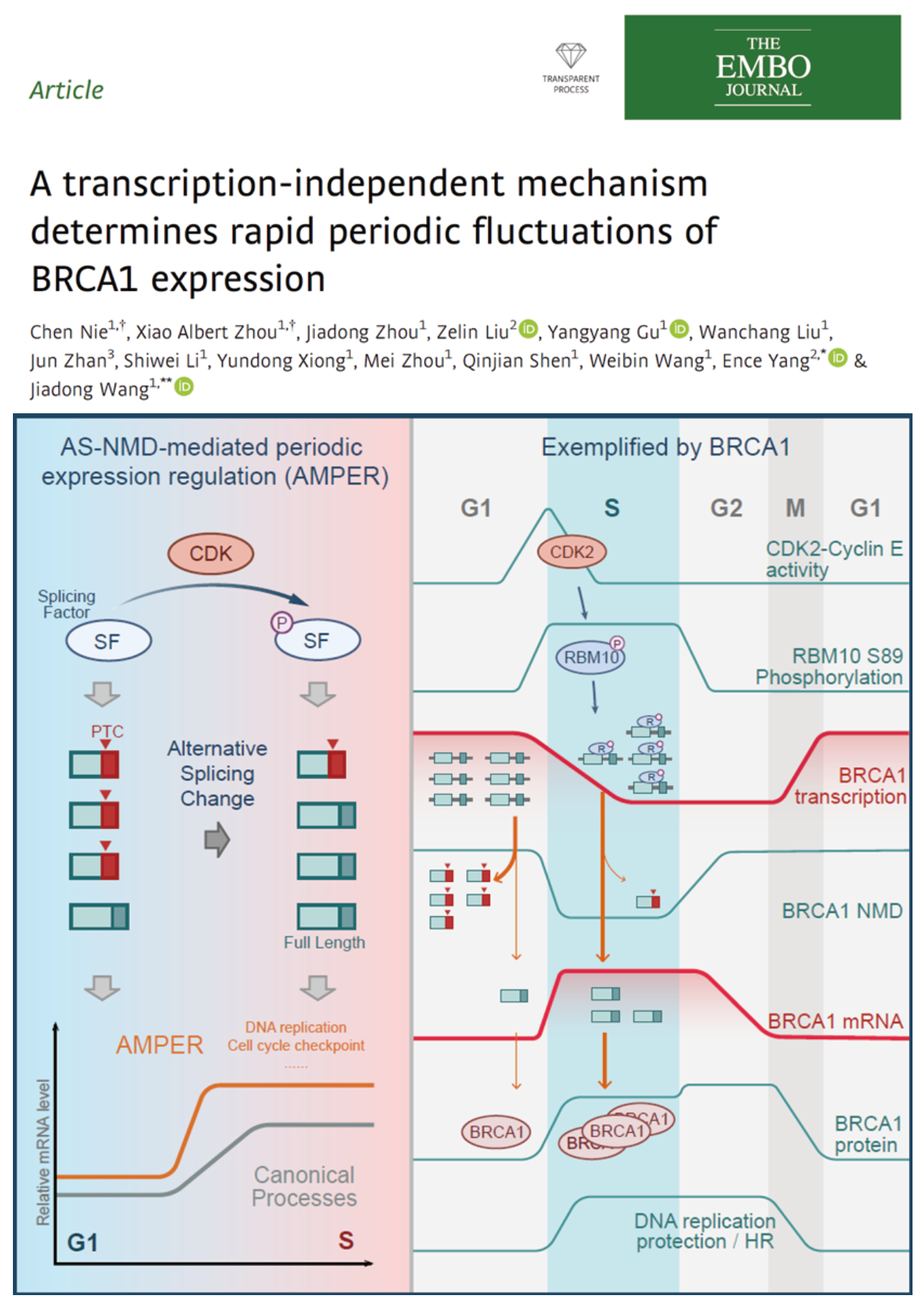
BRCA1是同源重组修复通路中的关键分子,BRCA1等同源重组修复通路相关基因异常表达是乳腺癌和卵巢癌等肿瘤发生的重要原因。BRCA1的蛋白表达会显著跟随细胞周期变化,在G1期,BRCA1需要保持低表达水平,防止不必要的同源重组引发基因组不稳定,而一旦进入S期,BRCA1表达会快速上升,介导精确的同源重组修复以及维持复制叉的稳定性。长期以来,BRCA1等基因mRNA水平的周期性表达被认为是CDK-Rb-E2F轴通过转录调控的。但是也有文献报道BRCA1蛋白会以负反馈的形式抑制自身转录,这种负反馈的调节机制同时也会抑制BRCA1基因从G1到S期的快速表达上升,因此形成了一个矛盾。在本研究中,作者首先确认了这种矛盾现象的存在,并且进一步研究发现BRCA1的周期性表达变化是由一种AS-NMD介导的转录非依赖的方式调控,从而避免了负反馈调控的影响,使BRCA1表达从G1到S期表达快速上升。
首先,作者首先确认了从G1到S期BRCA1确实呈现mRNA水平快速上升但同时转录水平显著下降的矛盾现象。随后通过GRO-seq(Global Run-on Sequencing)等手段发现是转录后的过程决定了BRCA1表达从G1到S期的快速增加。通过RNA-seq的组学分析,作者发现G1到S期BRCA1的可变剪接发生变化。在G1期,BRCA1在外显子5和11处的mRNA截短体isoform——5q和D11q——的相对水平更高,5q截短体isoform会被无意义介导的mRNA降解途径(NMD, nonsense-mediated mRNA decay)降解,这导致了G1期BRCA1的mRNA稳定性更差,水平更低(图1)。
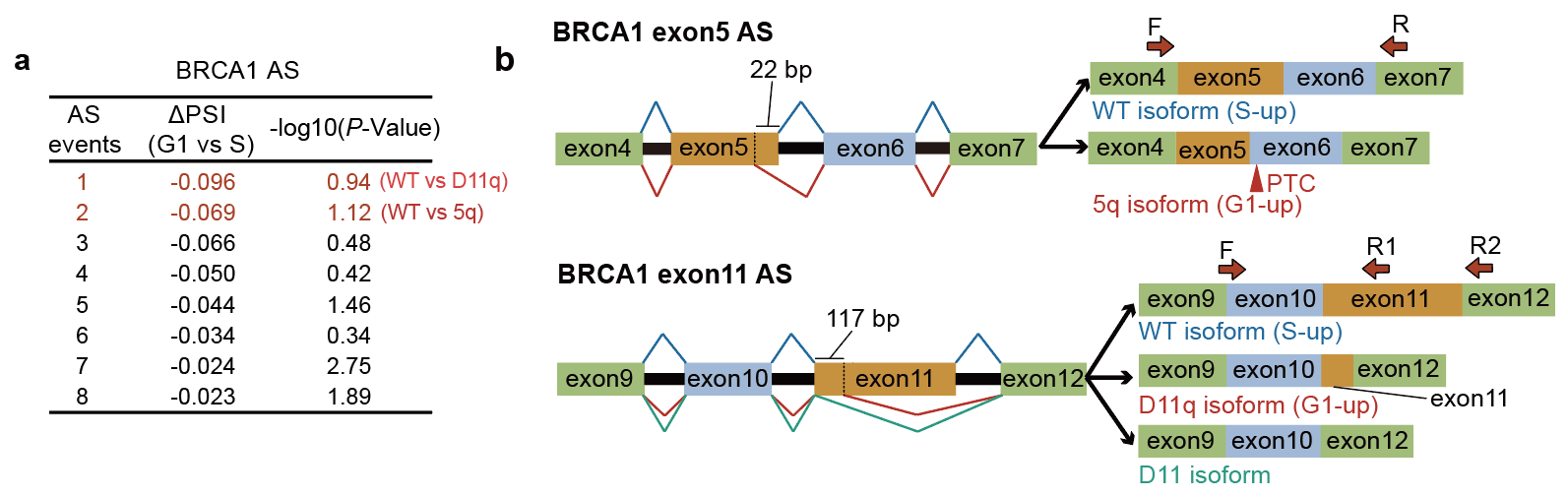
图1:BRCA1可变剪接随着周期变化
随后作者通过RNA pull-down偶联质谱寻找到潜在的调控BRCA1可变剪接的剪接因子RBM10(图2),敲低RBM10能够抑制BRCA1的G1到S期的表达水平增加的趋势。通过isoform特异性PCR的方法,作者验证了RBM10能够通过可变剪接抑制BRCA1的截短体isoform的产生。随后作者继续探究RBM10通过AS-NMD途径调控BRCA1周期性表达的上游通路。作者发现在S早期CDK2能够磷酸化RBM10的89号丝氨酸位点,高磷酸化水平的RBM10能够抑制BRCA1截短体isoform的产生,促进S期BRCA1的mRNA水平迅速增加。
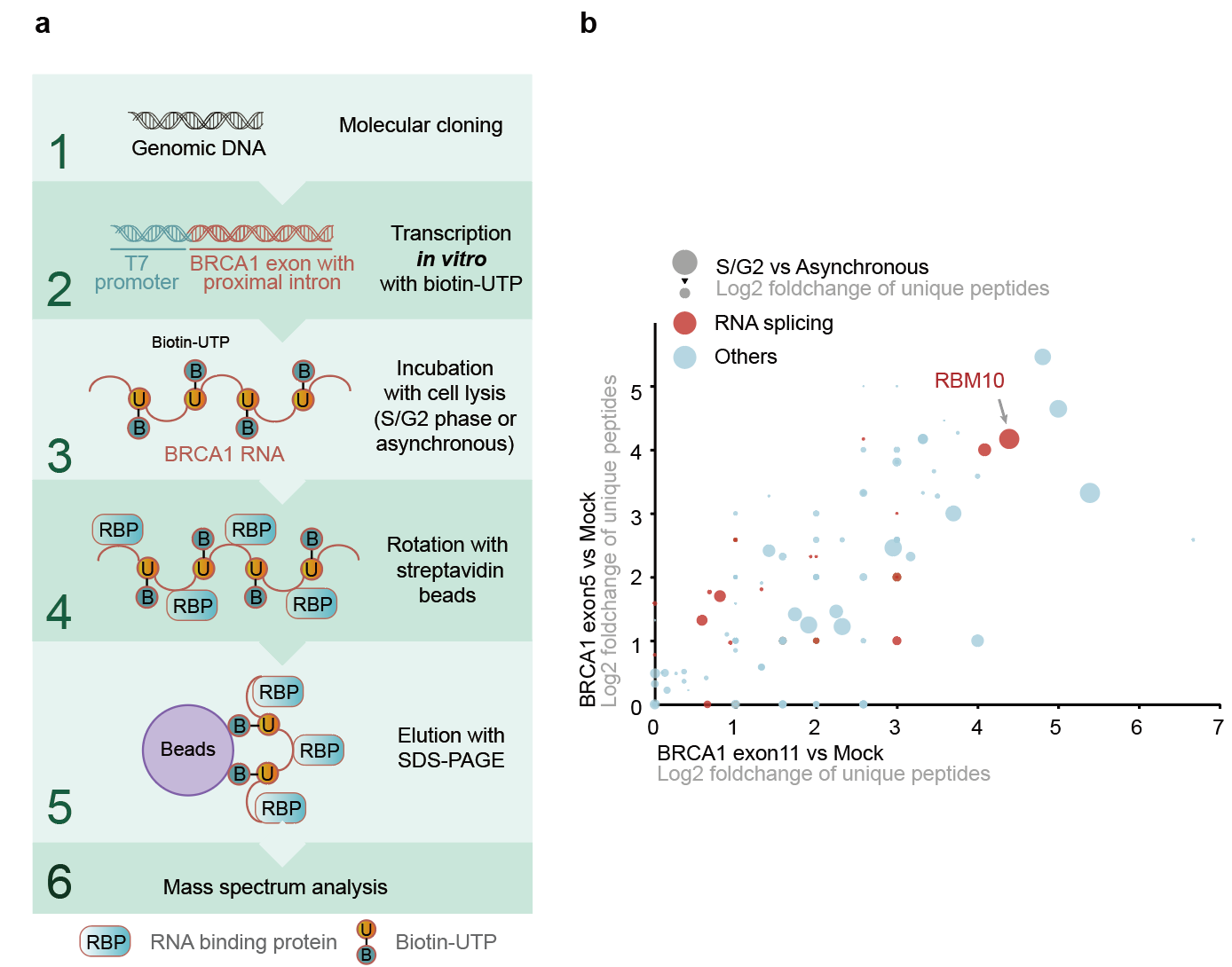
图2:RNA pull-down偶联质谱发现调控BRCA1的剪接因子RBM10
接下来,作者通过转录组组学发现,AS-NMD途径具有调控基因周期性表达的普遍性,它能调控DNA复制等通路基因G1到S期的表达增加的变化。抑制NMD途径,会抑制复制叉的速度,并且会加剧复制压力情况下复制叉的坍塌。此外受AS-NMD调控的周期表达基因群,相比于其它非AS-NMD调控基因群,体现为表达水平较高,和G1/S期的表达差异较大的特征。这提示类似于BRCA1这种重要基因,需要特定地在S/G2期发挥作用,表达水平也需要从G1到S期间快速增加,会更倾向于利用AS-NMD这种不经济但更为迅速的表达调控途径,而并非传统的转录途径(图3)。
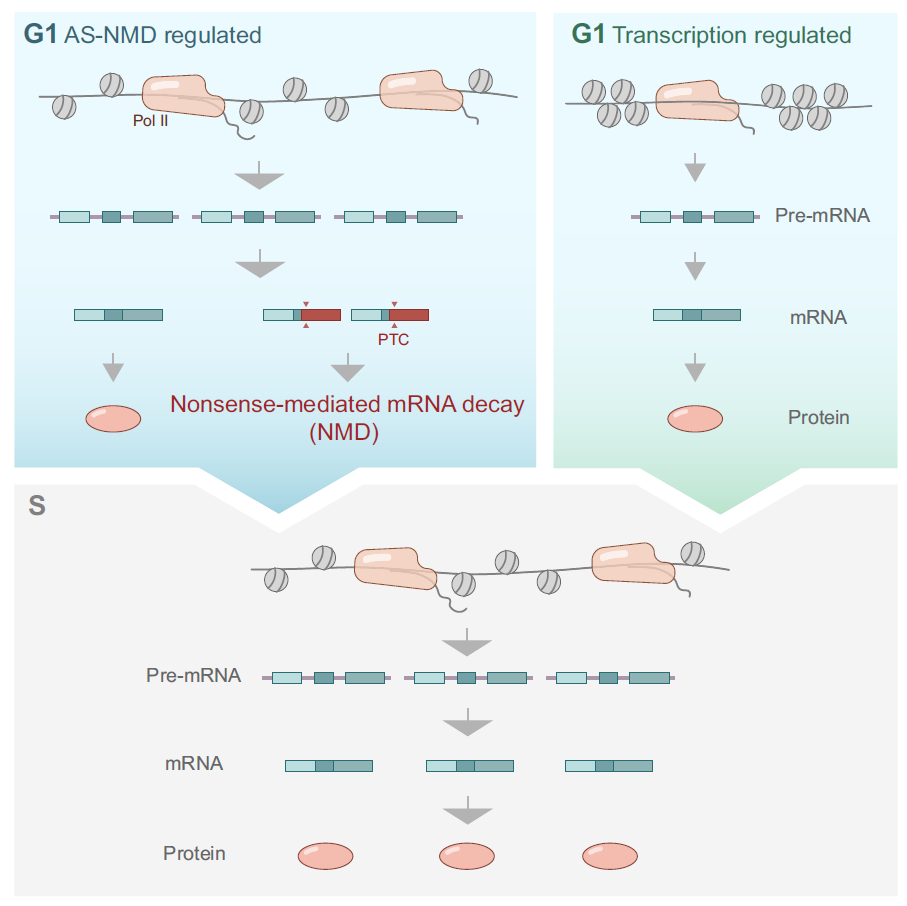
图3:AS-NMD途径调控众多基因的周期性表达
最后,作者发现RBM10通过BRCA1促进了同源重组修复与复制叉的稳定,提示RBM10可以作为肿瘤治疗靶点,尤其是卵巢癌等BRCA相关的肿瘤。在细胞和小鼠层面,作者发现CDK2抑制剂,能够通过靶向RBM10-BRCA1的表达调控轴,与PARP抑制剂联用协同地杀伤肿瘤细胞(图4),提示CDK2抑制剂和PARP抑制剂联用可能有较好的临床应用前景。
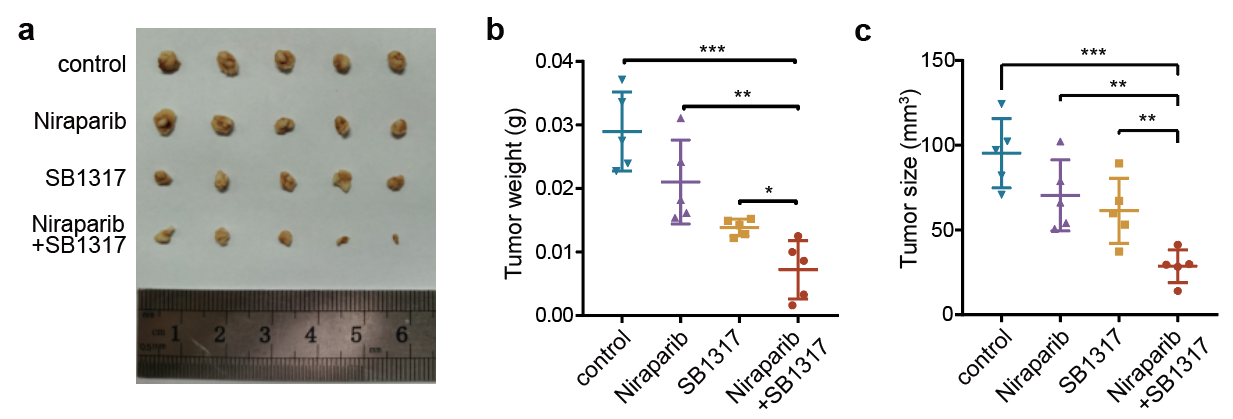
图4:CDK2抑制剂和PARP抑制剂联用协同杀伤卵巢癌
综上所述,该研究揭示了一种非传统的转录后的途径,调控BRCA1和其它复制通路基因周期性表达的机制,揭示了同源重组修复基因表达周期性波动的规律,还为同源重组修复基因表达异常的相关肿瘤治疗提供了潜在的治疗药物和治疗方式。
北京大学医学部基础医学院的博士后聂臣和博士后周筱为论文的共同第一作者,北京大学医学部基础医学院王嘉东教授和杨恩策研究员为该论文的共同通讯作者,北京大学基础医学院和北京大学国际癌症研究院为第一责任单位。该研究项目得到国家杰出青年基金、国家自然科学重点项目、科技部重点研发计划等项目的支持。

