科研动态
胰腺癌具有极差的预后和极高的致死率。胰腺癌患者的五年生存率不超过7%,而转移是包括胰腺癌在内的实体瘤致死的主要原因——90%患者的死亡源于转移。转移带来的系统性影响为胰腺癌的治疗带来巨大的挑战。因此对于胰腺癌发生发展特别是转移机制的探究和新疗法的开发对于患者的治疗至关重要。
2025年8月21日,北京大学基础医学院尹玉新/梁会团队在Nature Communications杂志在线发表题为“STN1 facilitates metastasis by promotingtranscription of EMT-activator ZEB1 inpancreatic cancer”的研究论文。该研究鉴定了在端粒稳定性维持方面发挥重要作用的CST复合体成员STN1为促进胰腺癌发生发展的关键因子,发现STN1结合在R-loop侧翼单链DNA上,通过招募STAT3促进ZEB1转录,从而加强了细胞的上皮-间质转化过程,继而促进胰腺癌转移。STAT3抑制剂对于STN1高表达细胞的转移能力具有更明显的抑制作用,提示对于STN1高表达的这部分胰腺癌患者,施加STAT3抑制剂是一种潜在的治疗策略。该研究拓展了胰腺癌转移相关机制的外沿,揭示了DNA结合蛋白在RNA相关结构上的重要功能,为胰腺癌患者的精准治疗提供了参考。

研究者首先通过生物信息学手段,利用胰腺癌患者已发表的转录组数据、芯片数据、单细胞数据筛选同时在患者肿瘤组织、恶性上皮细胞中高表达基因,鉴定到了692个高表达的基因。作者进一步研究了这些高表达基因与患者预后的关系,最终鉴定到了12个高表达与患者不良预后相关的基因。其中STN1对于胰腺癌进展的相关机制报道甚少,因此作者重点关注STN1分子在胰腺癌进展中的作用。他们首先在胰腺癌患者组织芯片、患者肿瘤组织cDNA、原发胰腺癌小鼠模型Pdx1-cre, KrasLSL.G12D/+; Tp53fl/fl(KPC)小鼠模型中对这一结论进行验证,确认了高表达STN1可导致患者不良预后。随后在胰腺癌细胞系中构建了STN1敲降和回补的稳转系,通过体内和体外转移实验发现敲降STN1可显著抑制胰腺癌细胞的转移能力。同时构建了基于CRISPR/Cas9的Stn1敲除小鼠模型并观察到Stn1-/+,Pdx1-creER, KrasLSL.G12D/+; Tp53fl/fl(KPCS)小鼠的形成肝转移灶和肺转移灶的能力显著下降而生存期显著延长。进一步通过在敲降稳转系中梯度回补STN1蛋白后发现STN1促进转移的能力随蛋白量的增加而增加,这与STN1在患者肿瘤组织中的表达差异导致了预后差异的结果相一致。为了进一步探究STN1在胰腺癌患者肿瘤组织中表达上调的原因,他们通过JASPAR数据库预测结合在STN1启动子区域的潜在转录因子,并通过敲降实验、双荧光素酶报告实验、ChIP-qPCR和转移相关实验发现重要的原癌蛋白HOXB7可以促进STN1的转录。
为进一步探究STN1促进胰腺癌转移的机理,作者首先对STN1敲降的细胞进行了RNA-seq检测,发现上皮-间质转化通路的显著抑制。通过western blot、免疫组化实验,在敲降稳转系和KPCS小鼠胰腺中检测到了上皮相关marker的上调和间质相关marker的下降。进一步发现STN1的降低伴随上皮-间质转化关键转录因子ZEB1的抑制。通过转录调控相关实验显示STN1可以促进ZEB1promoter的转录活性。通过亲和纯化质谱实验鉴定到与STN1结合的转录因子STAT3,且STN1通过其蛋白结合结构域wHTH2与STAT3结合。作者也发现STN1促进转移的功能也依赖其负责结合单链DNA的OB结构域,且EMSA结果显示STN1可以结合在ZEB1 promoter区域的R -loop上并招募STAT3促进ZEB1的转录。通过使用已经进入III 期临床试验的药物napabucasin(一种STAT3抑制剂)处理STN1过表达的细胞后观察到,STAT3抑制剂对细胞转移能力的抑制效果更明显。这个结果提示对于STN1高表达的这类胰腺癌患者,施加STAT3抑制剂或许是个可能的治疗选择。
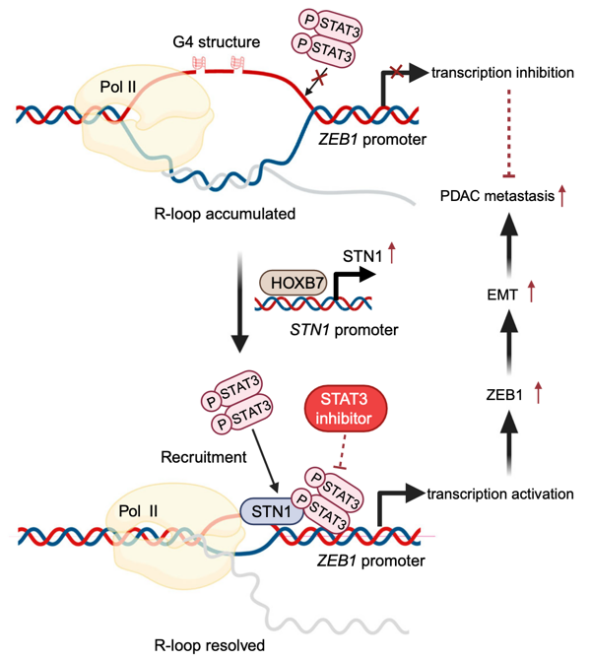
综上所述,该研究揭示了在端粒上发挥重要功能的蛋白CST复合体成员STN1在RNA相关结构上发挥转录调控的功能,阐明了STN1/STAT3/ZEB1轴对于上皮-间质转化和胰腺癌转移过程中的重要作用,并提示了STAT3抑制剂对于治疗特定胰腺癌患者群体的有效性。
北京大学基础医学院、北大-清华生命科学联合中心尹玉新教授和北京大学基础医学院梁会副研究员为本文的共同通讯作者。北京大学基础医学院博士毕业生董笛和北京大学生命科学学院博士后周喆为本文的共同第一作者。
原文链接:https://www.nature.com/articles/s41467-025-63083-0

