科研动态
2025年10月23日,北京大学基础医学院游富平、林志强、中国科学院过程工程研究所夏宇飞联合在国际学术期刊ADVANCED MATERIALS发表题为“Engineering a Lipid Nanoparticle with Atypical Calcium Crystal Structure for Enhanced IFNβ-Mediated Immunotherapy”的研究论文(图1)。

图1.本报道原始论文首页截图
免疫检查点抑制剂的出现革新了癌症治疗,但在实体瘤中,免疫治疗的应答率只有20-30%,这可能与先天性免疫反应对T 细胞的启动不足有关。金属离子在调节天然免疫反应中扮演着关键角色,然而,除了锰离子之外,有哪些金属离子通过激活干扰素促进树突状细胞成熟仍不清楚。
本研究鉴定了一种含有磷酸钙的纳米材料脂质体(NanoCa), 其内部结构疏松、拥有非典型的晶体结构和酸性条件下快速释放Ca2+的特征。被细胞内吞后,NanoCa通过溶酶体途径快速释放Ca2+, 随后通过Ca2+-CaN-NFATc2/PKCβ- IRF3 信号途径诱导产生干扰素β(IFNβ)。DCs作为关键的抗原呈递细胞,在NanoCa作用下成熟度显著提升,表面共刺激分子CD86和CD80 等表达增加,抗原摄取和呈递能力增强,并在不同的小鼠肿瘤模型中显示出抗肿瘤特性,包括B16 黑色素瘤、4T1 乳腺癌、CT26和MC38 结直肠癌等。且其抗肿瘤效果依赖于IFNβ信号—在IRF3或I 型干扰素受体缺陷小鼠中,NanoCa的抑瘤作用完全消失,这直接证实了IFNβ在其抗肿瘤过程中的核心地位(图2)。
图2.纳米钙通过激活骨髓来源树突状细胞的IFNβ,发挥“桥梁”作用,连接抗原呈递与抗肿瘤效应。
此外,在CT26 模型中,NanoCa与PD-1 抗体联合给药时表现出协同抗肿瘤作用,显著增强了疗效。单细胞RNA 测序结果进一步揭示了其作用机制:经NanoCa处理后,肿瘤微环境中浸润的树突状细胞(DC)、C1qc 阳性肿瘤相关巨噬细胞(C1qc⁺ TAM)及效应性CD8⁺ T 细胞(CD8T_eff)的数量显著增加;同时,肿瘤引流淋巴结中耗竭性CD8⁺ T 细胞(CD8T_ex)与具有免疫抑制功能的SPP1 阳性肿瘤相关巨噬细胞(SPP1⁺ TAM)的数量明显减少。上述结果表明,NanoCa在抗肿瘤免疫治疗领域具有良好的应用潜力(图3)。
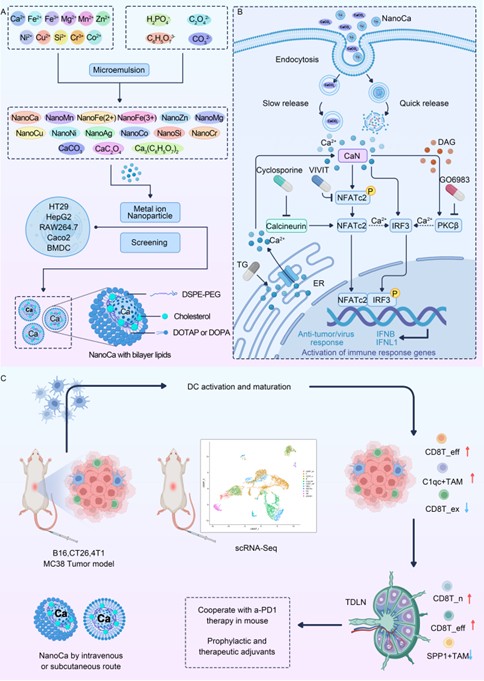
图3.具有非典型钙晶体结构的工程脂质纳米颗粒的示意图,用于增强IFNβ 介导的免疫治疗
钙离子(Ca²⁺)作为重要的第二信使,在免疫调节中功能多样。传统钙基佐剂如磷酸钙纳米颗粒仅能激发抗体反应,难以诱导强效的CD8⁺T 细胞介导的细胞免疫。NanoCa打破了这一局限,作为疫苗佐剂,NanoCa不仅能诱导与铝佐剂相当的抗体反应,更能激发强效的抗原特异性的细胞免疫。在OVA 疫苗模型中,NanoCa可诱导更多SIINFEKL⁺CD8⁺肿瘤浸润T 细胞,并产生持久的免疫记忆— 免疫后再接种肿瘤,结果显示,小鼠的肿瘤可被完全清除。
NanoCa的优势在于其良好的生物相容性,以及能够精准靶向脾脏等免疫器官激活IFNβ的特性。相较于传统锰基制剂,它有效避免了神经毒性;而与传统钙制剂相比,其独特的结构及通路激活能力则实现了从“单纯佐剂”向“免疫调节剂”的跨越。
未来,NanoCa有望在以下领域推动临床转化:作为免疫治疗增敏剂,与PD-1/PD-L1 抑制剂联用治疗难治性肿瘤;开发为新型疫苗佐剂,提升肿瘤疫苗或病毒疫苗的保护效力;探索其在慢性病毒感染(如乙型肝炎、HIV)中的治疗潜力。这项研究不仅为金属离子介导的免疫治疗开辟了新路径,更为解决当前免疫治疗中的“冷肿瘤”转化和耐药性等难题提供了潜在的解决方案。
北京大学系统所游富平研究员、林志强研究员和中国科学院过程工程研究所夏宇飞研究员是这一论文的共同通讯作者。北京大学基础医学院博士后雒钰杰和博士生祝传达为该研究的共同第一作者。该工作得到国家重点研发计划项目、国家自然科学基金以及北京市自然科学基金项目的资助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/adma.202419870

