学院新闻
周菁团队揭示血管壁基质几何形状如何影响平滑肌细胞的功能
2022年9月14日,北京大学医学部基础医学院生理学与病理生理学系的周菁课题组在Advanced Science杂志在线发表了题为Geometric constraints regulate energy metabolism and cellular contractility in vascular smooth muscle cells by coordinating mitochondrial DNA methylation的研究论文。该研究了揭示了核机械感受蛋白-细胞溶质磷脂酶 A2(cytosolic phospholipase A2,cPLA2)及其下游信号分子PI3K和 AKT1 在介导机械力诱导的DNA甲基转移酶1(DNMT1)转位效应中的作用,证明了基质几何形状是血管平滑肌细胞(VSMC)功能的关键决定因素。

机体组织和器官的结构与功能会受到组织中细胞几何形状的影响,而细胞的几何形状则受到组织微环境——细胞外基质(Extracellular Matrix,ECM)的限定。细胞几何形状在确定细胞功能中起着至关重要的作用【1,2】。尽管人们努力了解环境刺激对VSMC功能的影响及其对VSMC相关疾病发展的贡献,但响应细胞几何形状的VSMC功能调节机制仍有待阐明。
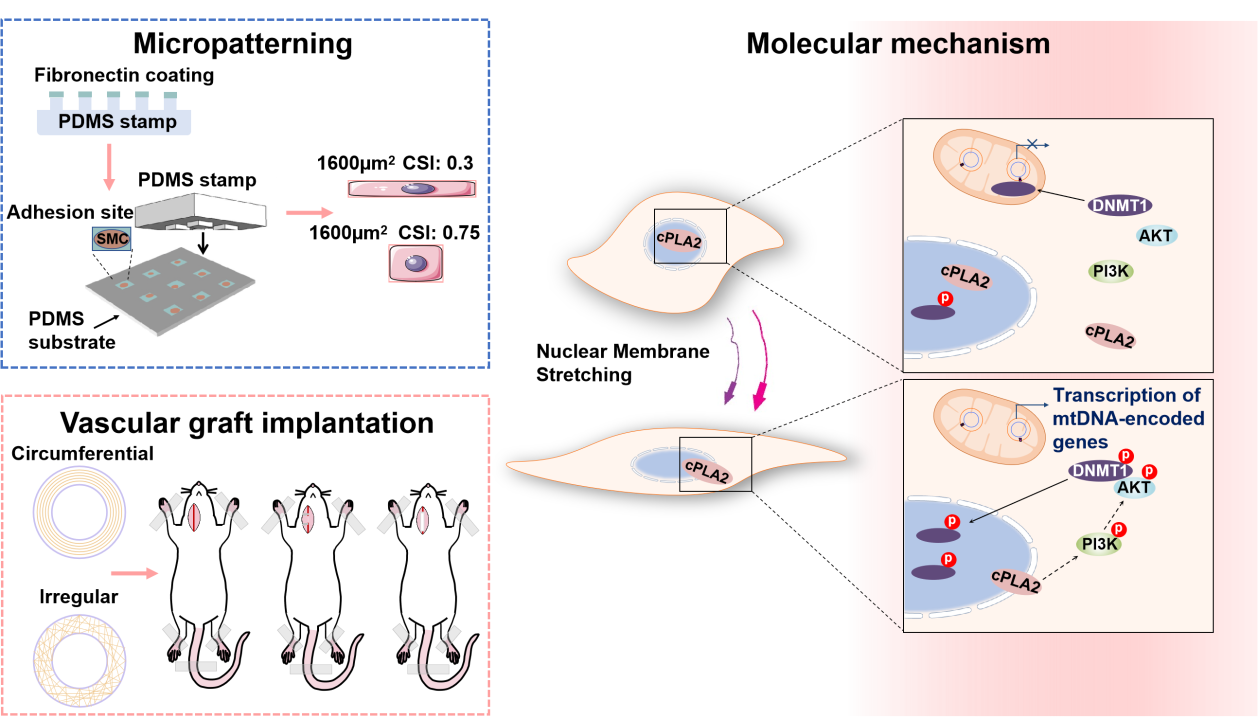
该课题组的前期工作中,发现在VSMC中的DNMT1在血小板衍生生长因子(PDGF)的刺激下经历了核到线粒体的重新分布,线粒体定位的DNMT1 可与线粒体DNA(mtDNA)的D-loop 结合,并最终导致mtDNA转录抑制【3】。然而,尚不清楚mtDNA的这种表观遗传修饰是否也会受到细胞所处的物理微环境的调控。课题组最新的这项研究结合二维微图案模型和三维人工血管移植模型,发现了基质几何形状所传递的物理信号在 VSMC 中诱导一系列具有内在联系的现象,包括 DNMT1 的亚细胞重新分布和 mtDNA 甲基化水平的变化、DNMT1 与 mtDNA 的结合、mtDNA 基因转录、线粒体功能和能量代谢改变。研究结果证明了核机械感受蛋白——胞质型磷脂酶A2 (cPLA2) 感知细胞核膜形状、面积改变,激活其及其下游信号分子 PI3K 和 AKT1 ,通过调控DNMT1的磷酸化引起DNMT1胞内易位 。研究结果表明,基质几何形状是 VSMC功能的关键决定因素,因此,具有可控微/纳米结构的工程血管移植物可能是提高其性能的有效策略。
周菁课题组致力于对各种模拟不同胞外物理微环境(如血流剪切和机械牵张、基质刚度与拓扑等)的在体和离体模型系统的开发和应用,并利用其研究血管疾病发生发展过程中的力学生物学机制。北京大学基础医学院周菁研究员是本研究论文的通讯作者。北京大学基础医学院刘瀚博士、刘跃峰博士是本论文的共同第一作者。本研究得到了南开大学生命科学学院赵强教授、深圳湾实验室彭琴研究员、北京大学人民医院张韬副教授的帮助,得到了国家自然科学基金、北京市自然科学基金、北京大学医学部加强基础研究专项的经费支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202203995
参考文献:
【1】Suzuki, M., H. Morita, and N. Ueno, Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Dev Growth Differ, 2012. 54(3): p. 266-76.
【2】Odero-Marah, V., et al., Epithelial-Mesenchymal Transition (EMT) and Prostate Cancer. Adv Exp Med Biol, 2018. 1095: p. 101-110.
【3】Liu, Y.F., et al., Hypermethylation of mitochondrial DNA in vascular smooth muscle cells impairs cell contractility. Cell Death Dis, 2020. 11(1): p. 35.
(北京大学基础医学院)

