学院新闻
杨宝学/孙金鹏/铁璐团队揭示尿素转运机制及尿素通道抑制剂的多样作用模式
2024年11月26日,基础医学院孙金鹏教授团队联合杨宝学教授团队,铁璐教授团队在Nature Communications杂志在线发表了题为Structural insights into the mechanisms of urea permeation and distinct inhibition modes of urea transporters的研究论文,揭示了UT跨膜转运尿素分子的结构基础以及竞争型、非竞争型和不竞争型UT抑制剂的作用模式,为靶向UT设计和开发选择性抑制剂作为新型利尿药提供了直接结构依据。

尿素是自然界中最普遍的有机化合物之一,也是人和动物体内氨基酸代谢的最终产物。尿素分布于人体全身各处组织,是一种重要的渗透性溶质,在维持机体正常的渗透压平衡方面发挥着不可或缺的作用。尿素的快速跨膜运输需要通过尿素通道蛋白(Urea Transporter, UT)这类特异性通透尿素的跨膜蛋白实现,其速度是简单扩散的10-100倍。肾脏是人体调节尿素浓度最重要的器官,由尿素和钠离子共同形成的肾皮质到髓质的渗透压梯度,决定了肾脏的尿浓缩能力。UT在肾脏的生理学功能已比较清楚。肾内髓组织的尿素浓度梯度和渗透压梯度主要依赖UT-A1,-A2,-A3和-B亚型介导的肾内尿素循环,在尿浓缩机制中发挥重要作用。选择性敲除UT-A1/UT-A3、UT-A2或UT-B,可以阻断肾脏内的尿素循环路径,减弱尿液的浓缩能力,并且这一过程不干扰Na+、K+、Cl-的排泄,属于“尿素选择性利尿”现象。这表明尿素通道蛋白有可能成为新型利尿药物的作用靶点,其抑制剂有望被开发为创新型的利尿剂。尿素通道抑制剂的利尿效果具有一个显著优势,即利尿的同时不会影响体内电解质的平衡,适合高血压、心力衰竭和水肿等慢性病患者长期使用。近年来,以尿素通道蛋白为作用靶点的药物研发逐渐受到关注,新的作用机制和化合物也在持续发展,成为该领域的研究热点。
该研究中,作者通过表达量筛选体系,体外表达多种不同的UT亚型,并通过冷冻电镜解析了人源UT-A2,UT-A3,UT-B和斑马鱼UT在静息状态(Apo)以及UT-A2结合尿素分子,抑制剂分子25a,ATB3,CF11和HQA2状态的高分辨率结构。通过结构性分析,结合分子动力学模拟、序列比对和突变验证分析,作者首次直接观测到尿素分子结合在UT通道中的状态,发现UT转运通道中保守的尿素分子识别基序(URM),包括胞内侧和胞外侧的两个尿素分子结合口袋EUBP和CUBP,主要参与了尿素的识别和运输过程(图一A-B)。尿素分子在渗透压的驱动下,通过两个口袋上高度保守的“Q-T-T-Q”极性氨基酸基序进行氢键传递,沿着UT通道实现跨膜运输的进程(图一C)。
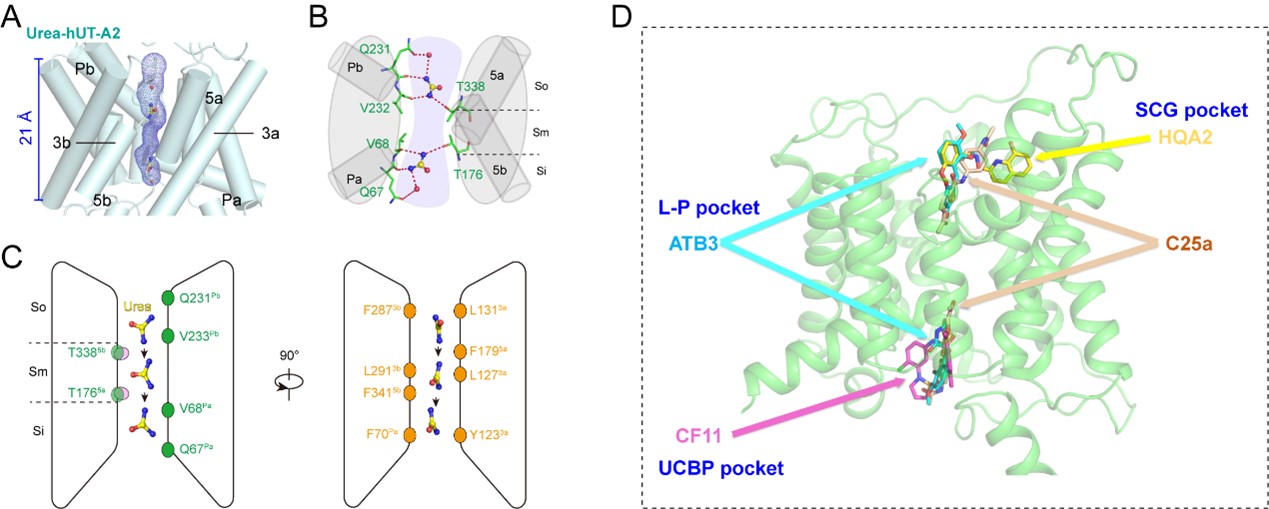
图一尿素分子与UT的结合转运模式及UT抑制剂的多样作用模式
此外,联合团队还分析了竞争型、非竞争型和不竞争型UT抑制剂与UT-A2作用模式的差异。两种竞争型抑制剂C25a和ATB3通过占据了EUBP和CUBP,与尿素竞争与“Q-T-T-Q”基序的氢键作用,从而竞争性阻断尿素的跨膜运输。此外,作者也发现UT-A2的胞外端抑制剂结合口袋EBBP中非保守残基L202和P336(也称为L-P口袋),是设计hUT-A2的选择性竞争型抑制剂的关键氨基酸。与竞争型制剂不同,非竞争型抑制剂CF11和不竞争型抑制剂HQA2分别结合在通道内侧和通道外侧的两个不同口袋,并不占据EUBP和CUBP。CF11仅与通道内侧的UCBP结合,允许尿素进入UT通道但阻止尿素跨膜运输进程,而HQA2只结合在通道外侧,与SCG次级口袋作用,同样不直接阻断尿素分子进入到转运通道。UCBP和SCG口袋中存在不保守的关键氨基酸,可应用于设计不同作用模式的UT-A2的选择性抑制剂。
综上所述,该研究直接揭示了尿素分子与UT结合的结构基础,阐明了尿素分子通过UT进行跨膜运输的动态过程,还发掘了不同类型抑制剂与UT-A2的作用模式,为设计和开发竞争型、非竞争型或不竞争型选择性UT-A抑制剂提供理论指导。
山东大学黄深明副研究员,北京大学黄之贞博士,熊梦瑶博士和蔡柏阳博士,山东大学王明威博士后,张超博士,山东大学第二医院刘磊博士后,为本文共同第一作者。孙金鹏教授、杨宝学教授和铁璐教授为本文通讯作者。文章写作方面得到了山东大学于晓教授的指导。
原文链接:https://www.nature.com/articles/s41467-024-54305-y
孙金鹏教授团队长期从事膜受体GPCR的细胞信号转导和微观环境药理学研究,近年来在肾脏相关GPCR的研究中取得了系列成果。与山东大学易凡教授合作揭示了肾脏中黏附类GPCR GPR97在急性肾损伤中促炎并加重肾损伤的机制(J Am Soc Nephrol. 2018; 29:1475-1489),还揭示氧化型胆固醇受体GPR183促进内皮衰老及心肾损伤的新机制及干预策略(Circ Res. 2024 Sep 13;135(7):708-721)。进一步与浙江大学张岩教授合作,筛选发现糖皮质激素是GPR97的内源性配体并阐明GPR97的促炎机制(Nature, 2021a; 589: 620-626)。孙金鹏教授还带领团队揭示了肾脏加压素受体V2R磷酸化编码调控下游多样性信号转导的时序效应(Nat Commun. 2021; 12(1): 2396;Anal Chem. 2019 Dec 3;91(23):14936-14942.),阐述了靶向前列腺素受体调控肾脏稳态的药学新方法及单个内源性配体引起同一GPCR多样性信号转导的分子机制(PNAS. 2023 Jul 25;120(30):e2216329120.)。杨宝学教授团队主要研究包括肾脏疾病发病机制与药物靶点确认、新型利尿药研发、灵芝的药理学作用及其机制研究等。近年来先后揭示了ADPKD病理生理机制及药物治疗机制(J Am Soc Nephrol 2021,2019,2018,2008;Sci. Adv 2019,Kidney Int 2017);发现并揭示了新型利尿药靶点及药物作用机制(Acta Pharm Sin B 2021,Kidney Int 2013,J Am Soc Nephrol 2012);深入开展膜通道蛋白相关药理及生理研究(J Biol Chem 2020,Kidney Int 2017,J Am Soc Nephrol 2015)。这些研究为治疗相关肾脏疾病开发精准靶向药物提供了新的思路和策略。铁璐教授团队主要从事组织损伤修复药理学研究,近年来在相关研究中已取得了系列成果,揭示了线粒体质量控制和组织损伤修复方面的药理作用(Nat Commun 2023, Acta Pharmacol Sin 2024a,Clin Immunol 2022,Br J Pharmacol 2020,Biochim Biophys Acta Mol Basis Dis 2018),发展组织损伤修复的相关治疗方法与策略(Acta Pharmacol Sin 2024b,Eur J Pharmacol 2022,Apoptosis2014,J Nutr Biochem 2013)。

