学院新闻
Nat Commun |刘小云/罗招庆/付嘉琦实验室合作发现志贺氏菌逃逸宿主囚禁的全新机制
许多革兰氏阴性病原菌通过Ⅲ型分泌系统(Type III Secretion System, T3SS)向宿主细胞“注射”效应蛋白(Effector),靶向细胞中的关键信号分子,模拟或操纵宿主的信号通路,进而促进病原菌的入侵和增殖。志贺氏菌(Shigella)是引起人类细菌性痢疾的主要病原体,它能以极高的效率突破免疫防御,引起出血性腹泻和严重的肠道炎症。然而,目前我们对志贺氏菌致病分子机制的认识仍十分有限。课题组前期与邵峰院士实验室合作发现志贺氏菌效应蛋白OspC3通过全新翻译后修饰(ADP-riboxanation)抑制宿主细胞焦亡(Nature 2021),与邱家章/张培培实验室合作发现OspC蛋白家族可共同靶向真核翻译起始因子eIF3并诱导宿主应激颗粒的形成(Cell Rep 2024)。
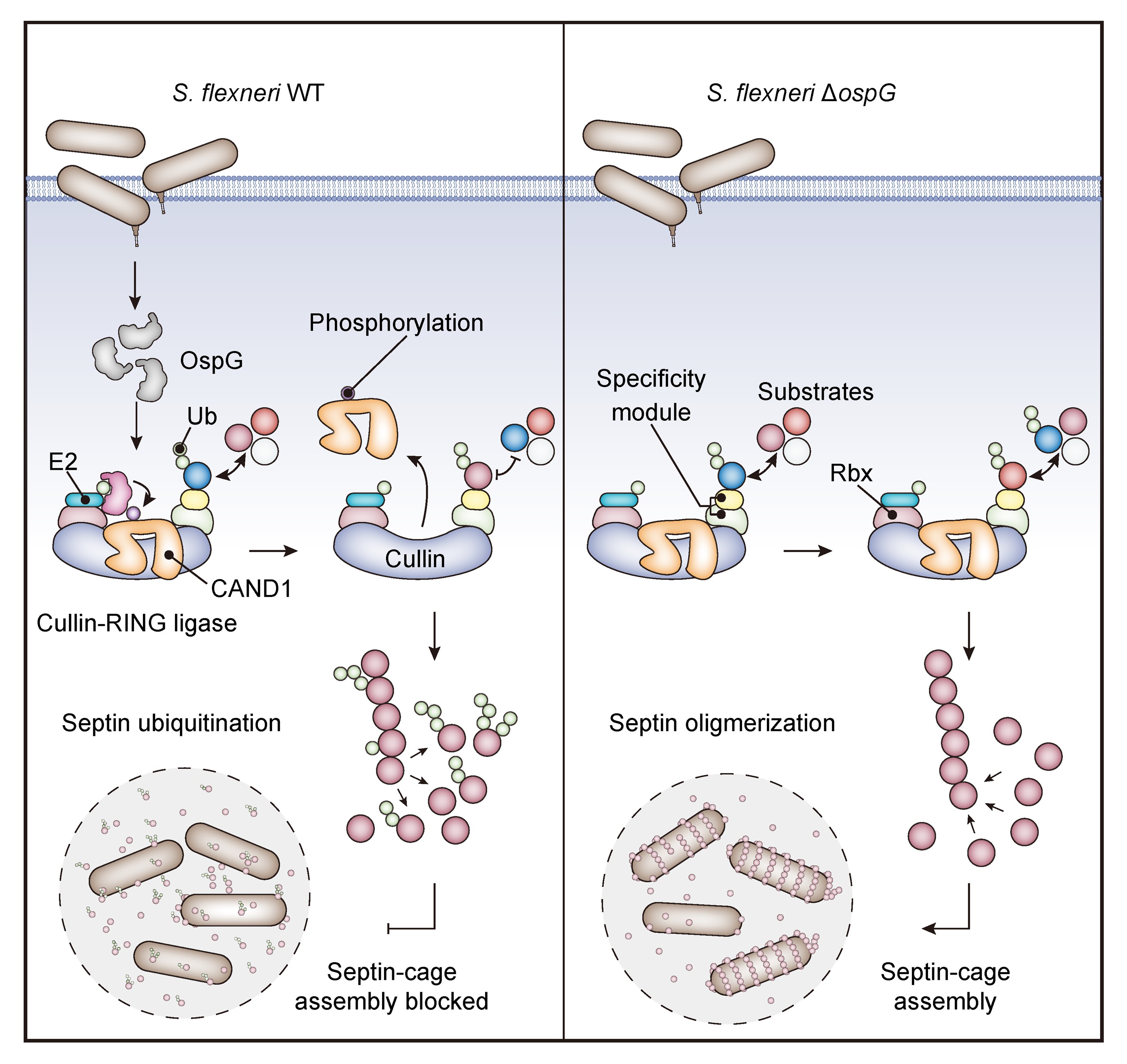
泛素化是真核生物中一种高度保守的蛋白质翻译后修饰,在细胞生命活动中发挥重要作用。病原细菌不具备完整的泛素化系统,但在与宿主长期互作中,已进化出许多先进的策略“劫持”宿主泛素化途径,从而逃避宿主免疫攻击,达到增强侵染的目的。如志贺氏菌分泌的IpaH效应蛋白家族可发挥E3泛素连接酶活性(Nature 2017,Cell 2021),课题组前期与罗招庆/邱家章实验室合作发现嗜肺军团菌SidE效应蛋白家族可催化不依赖于E1/2的非经典泛素化修饰(Nature 2016,Cell Rep 2023)等。早期研究发现效应蛋白OspG是志贺氏菌分泌的一种蛋白激酶,可与泛素和泛素结合酶E2相互作用(PNAS 2005,EMBO J 2014,Structure 2014),提示该蛋白或参与调控宿主泛素化过程。然而,E2和泛素并非OspG的磷酸化底物,OspG的激酶靶标及相关生物学功能至今尚未明确。
2024年5月8日,北京大学基础医学院刘小云实验室与普渡大学罗招庆实验室、吉林大学第一医院付嘉琦实验室合作,在Nature Communications上发表了题为“The Shigella kinase effector OspG modulates host ubiquitin signaling to escape septin-cage entrapment”的研究论文。该研究运用多重蛋白质修饰组学策略,鉴定了OspG的激酶底物,并揭示了志贺氏菌通过蛋白质磷酸化调控宿主泛素化途径的全新机制。

该研究首先运用大规模磷酸化修饰组学方法筛选OspG的激酶底物,发现Cullin–RING泛素连接酶(Cullin–RING Ligases, CRLs)的底物招募调节因子CAND1(Cullin-associated and neddylation-dissociated protein 1)为OspG的酶活靶标,OspG介导CAND1磷酸化,进而破坏其与CRLs支架蛋白Cullin的相互作用。进一步高通量泛素化修饰组学提示OspG可显著重塑宿主蛋白质泛素化全景图,其中细胞骨架蛋白septin家族的泛素化水平明显增强。先前研究发现,septin可在志贺氏菌感染宿主细胞时形成笼状结构(septin-cage)以“囚禁”病原体,从而启动宿主的细胞自噬防御,并限制细菌的细胞间传播。为此,研究团队进一步通过免疫荧光成像考察了OspG对于septin-cage形成的影响,发现OspG介导的septin泛素化可显著抑制志贺氏菌感染时宿主细胞内septin-cage的组装。综上,该研究揭示了志贺氏菌可利用其编码的一个效应蛋白激酶,通过磷酸化方式调控CRLs的功能,进而影响下游septin蛋白家族的泛素化,从而达到逃逸宿主自主防御的目的。
北京大学基础医学院病原生物学系刘小云研究员和普渡大学罗招庆教授是本文的共同通讯作者。北京大学博士生冼伟和吉林大学第一医院付嘉琦研究员是本文的共同第一作者。该研究受到国家自然科学基金面上项目、国家重点研发计划等项目的资助。

