学院新闻
Protein & Cell丨刘从容/吴聪颖团队揭示上皮性卵巢癌腹膜腔播散新机制
上皮性卵巢癌(EOC)是最常见的女性肿瘤致死性疾病,EOC一般缺乏早期症状,通常在确诊时已伴有广泛盆腔种植播散,难以通过手术完全清除,约65%的患者会在明确诊断后5年内因复发和化疗耐药而死亡。与其它肿瘤不同,EOC的转移方式主要是在腹水中漂浮生长和盆腔内种植转移。腹膜腔播散通常会导致EOC的临床分期增高、肿瘤减灭术不满意和患者生存率大幅度下降。因此,临床迫切需要研究EOC腹膜扩散机制,寻找有效生物标记物和敏感治疗靶标,以此来改善和提高EOC患者预后及临床疗效。
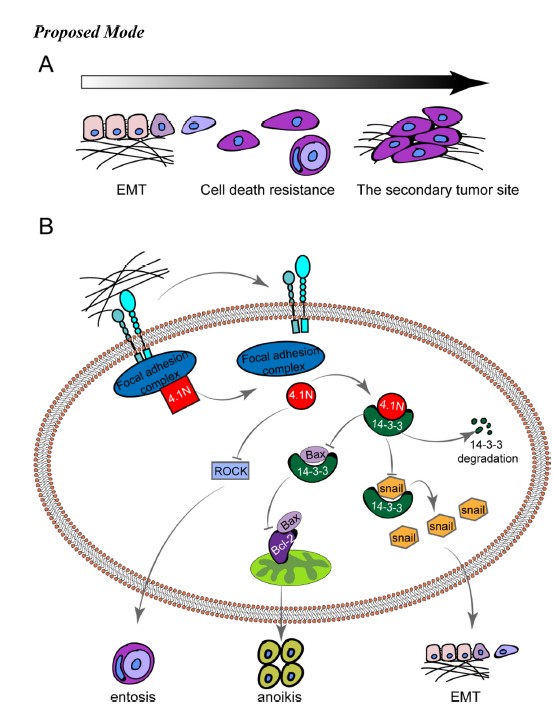
2020年5月25日,北京大学基础医学院病理系/北京大学第三医院病理科刘从容主任医师/副教授与北京大学系统生物医学研究所吴聪颖研究员合作在Protein & Cell在线发表了题为“Loss of 4。1N in epithelial ovarian cancer results in EMT and matrix-detached cell death resistance”的研究论文。该团队首次发现4。1N蛋白对EOC的恶性生物学行为具有负性调控作用,4。1N缺失会减少14-3-3的降解并可诱导entosis(细胞内侵)的发生,借此促进EMT和失巢凋亡逃逸,最终上调EOC的腹膜腔播散能力。单独或联合应用4。1N过表达、14-3-3拮抗剂和ROCK抑制剂有望作为EOC治疗新策略的备选靶点。

该团队首先收集268例EOC石蜡组织样本,运用免疫组化检测4。1N蛋白表达情况,并与EOC患者临床相关性进行分析,发现4。1N的蛋白表达水平在FIGO III期和IV期病例中显著低于I期病例,Kaplan-Meier生存分析显示,在本组EOC样本中,4。1N低表达组出现复发的时间显著早于高表达组,4。1N低表达组的总生存期显著低于高表达组。
该研究进一步探讨了EOC细胞中4。1N表达对EMT生物学行为的影响,发现4。1N表达缺失正性调控EOC细胞的EMT分子表型及迁移和侵袭能力;在贴壁培养条件下,4。1N表达水平对细胞凋亡缺乏显著影响,考虑到EOC细胞播散进入腹腔后将面临失巢凋亡的挑战,研究者在模拟细胞-基质失黏附的环境后,再次检测了细胞的凋亡情况,发现4。1N的表达缺失导致EOC细胞凋亡率显著降低。
随后,研究者对上述生物学机制进行了详细的研究,首先利用Co-IP/LC-MS/MS、Co-IP、Gst-pulldown和免疫荧光实验,发现4。1N与14-3-3具有物理上的相互作用,进一步实验发现4。1N在蛋白水平和mRNA水平上均可负性调控14-3-3,而这种负性调控是通过4。1N促进14-3-3的降解引起的,并且4。1N对EMT和失巢凋亡的调控依赖于14-3-3。
更有意思的是,研究者在探讨4。1N对EOC细胞生物学行为影响的过程中发现,在失黏附培养条件下,4。1N的表达缺失可以诱导EOC细胞发生细胞内侵(entosis),即一个细胞入侵另一个相邻细胞继发形成的细胞内细胞结构。进一步的实验研究表明,entosis不会显著影响失黏附培养下EOC细胞的死亡;4。1N表达与4。1N缺失细胞之间并没有通过entosis形成竞争关系,仅在4。1N缺失的细胞中高频发生;借助entosis的生物学行为,4。1N缺失细胞对丧失基质黏附所诱导细胞死亡(失巢凋亡)的逃逸能力显著增加。综上,4。1N缺失可以通过正向调控entosis促进EOC演进的关键步骤-腹膜腔种植转移的发生。
最后,研究者在裸鼠腹腔种植转移模型和EOC患者组织样本中进行体内验证,得出了与上述结果一致的结论。
综上所述,该研究为EOC腹膜腔播散提出了新机制,也为EOC治疗提供了全新思路和备选靶点。
刘从容主任医师/副教授和吴聪颖研究员为该论文的通讯作者。王丹丹(博士生)和张乐天(博士生)为该论文的共同第一作者。
原文链接https://link。springer。com/article/10。1007/s13238-020-00723-9