学院新闻
Cell | 北京大学基础医学院徐成冉课题组揭示单细胞分辨率下内胚层器官发生的时空轨迹与遗传谱系

2025年1月16日,北京大学基础医学院、女性生育力促进全国重点实验室徐成冉课题组在学术期刊《Cell》发表了题为“Spatiotemporal and genetic cell lineage tracing of endodermal organogenesis at single-cell resolution”的研究论文。该研究整合遗传追踪、单细胞分析及高分辨率成像技术,在单细胞分辨率下全面解析了哺乳动物内胚层的器官发生过程,提出了新的内胚层细胞分化模型,为发育生物学和再生医学研究提供了重要的理论支持。
哺乳动物内胚层通过复杂的细胞命运决定过程发育为呼吸系统、消化系统以及多个附属器官。然而,对于这些器官发生的早期细胞分化过程,尤其是胚胎第8.5天(E8.5)至第9.5天(E9.5)的关键阶段,目前仍缺乏全面的理解。为此,研究团队设计了创新性的遗传追踪编码,结合单细胞转录组测序(scRNA-seq)和时间序列成像技术,对14个内胚层亚区的谱系轨迹及空间分布进行了精准分析。
研究亮点与重要发现
1. 创新的遗传追踪编码:研究团队利用Cre-loxP系统开发了九种转基因小鼠品系,实现了对14个内胚层亚区 的单独追踪与标记。通过荧光蛋白标记,这些编码使每个内胚层亚区的遗传身份清晰可辨(图1)。
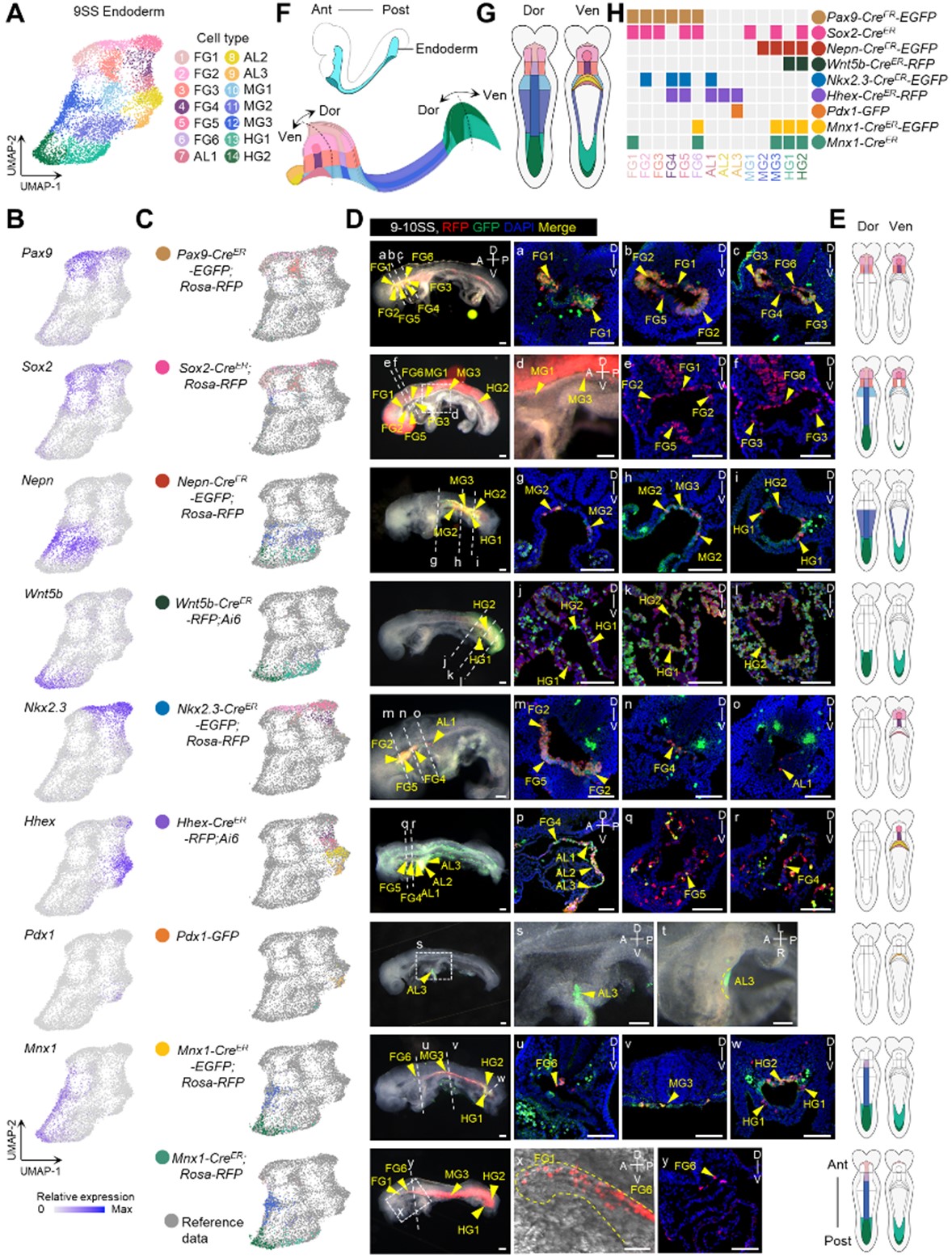
图1 内胚层谱系分化的遗传追踪编码的生成
2. 揭示内胚层的多潜能与多起源现象:通过单细胞转录组测序和谱系亲和指数(Lineage Affinity Index, LAI)分析,研究发现大多数内胚层亚区具有多种发育潜能。同时,器官原基发育表现出广泛的多起源现象。例如,肺、胃、肝、胰腺、小肠和大肠等器官均由多个亚区共同贡献,揭示了器官发生过程中广泛的多起源现象(图2)。

图2 从9SS到27SS内胚层发育轨迹的推断和构建
3. 器官发生的空间模式:通过高质量的成像技术进一步解析了内胚层器官发生的空间轨迹(图3),发现器官发生在空间上呈现“混合型”和“拼接型”两种模式。混合型(如肺和肝)显示不同来源细胞的混合分布,而拼接型(如胃肠道)表现为不同来源细胞在空间上的区域拼接。
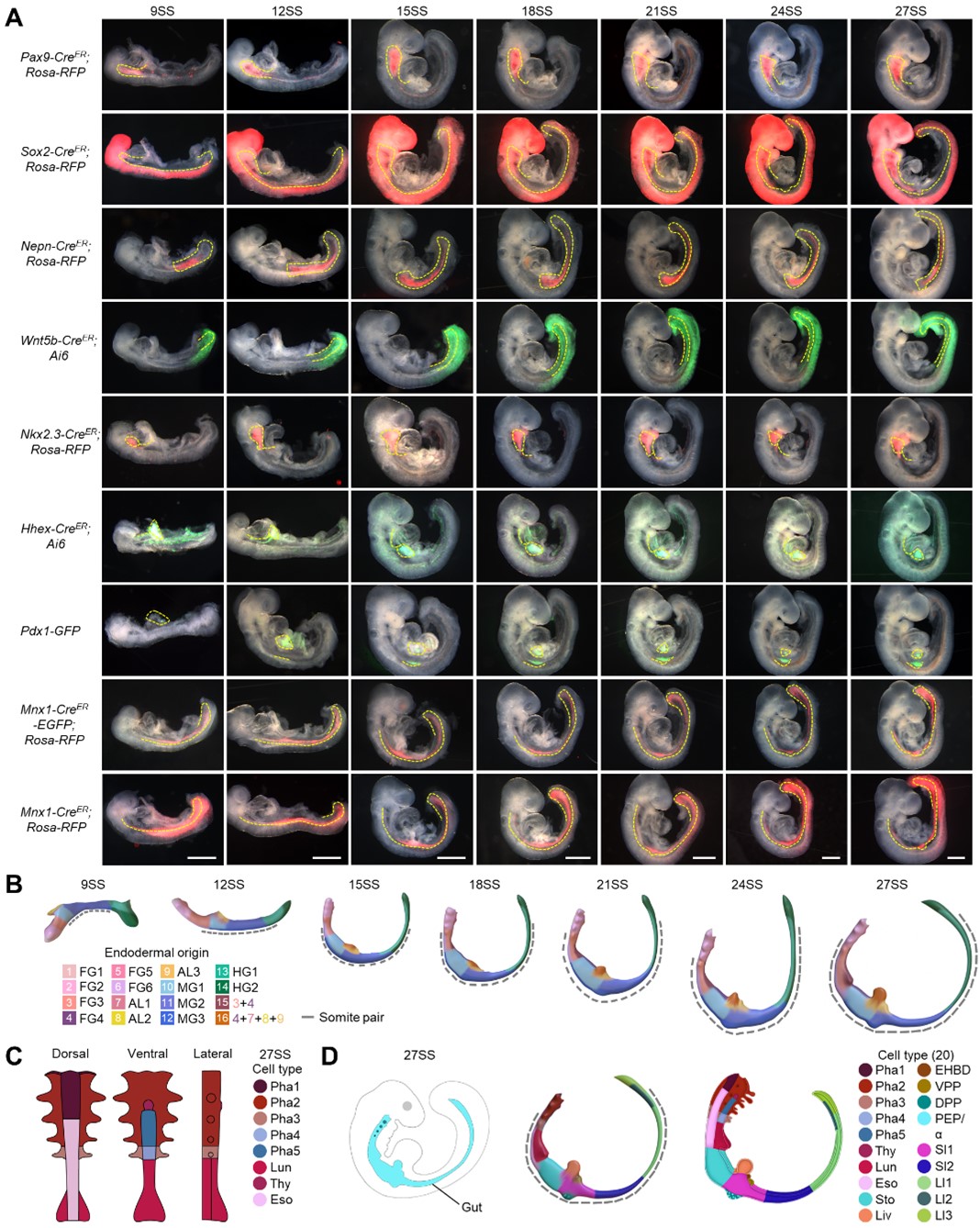
图3 从9SS到27SS内胚层区域的时空发育模式
4. 重新定义胰腺发育路径:研究揭示了胰腺的多元发育路径,发现早期胰腺内分泌细胞直接来源于内胚层细胞,而非传统观点中的胰腺祖细胞(图4)。
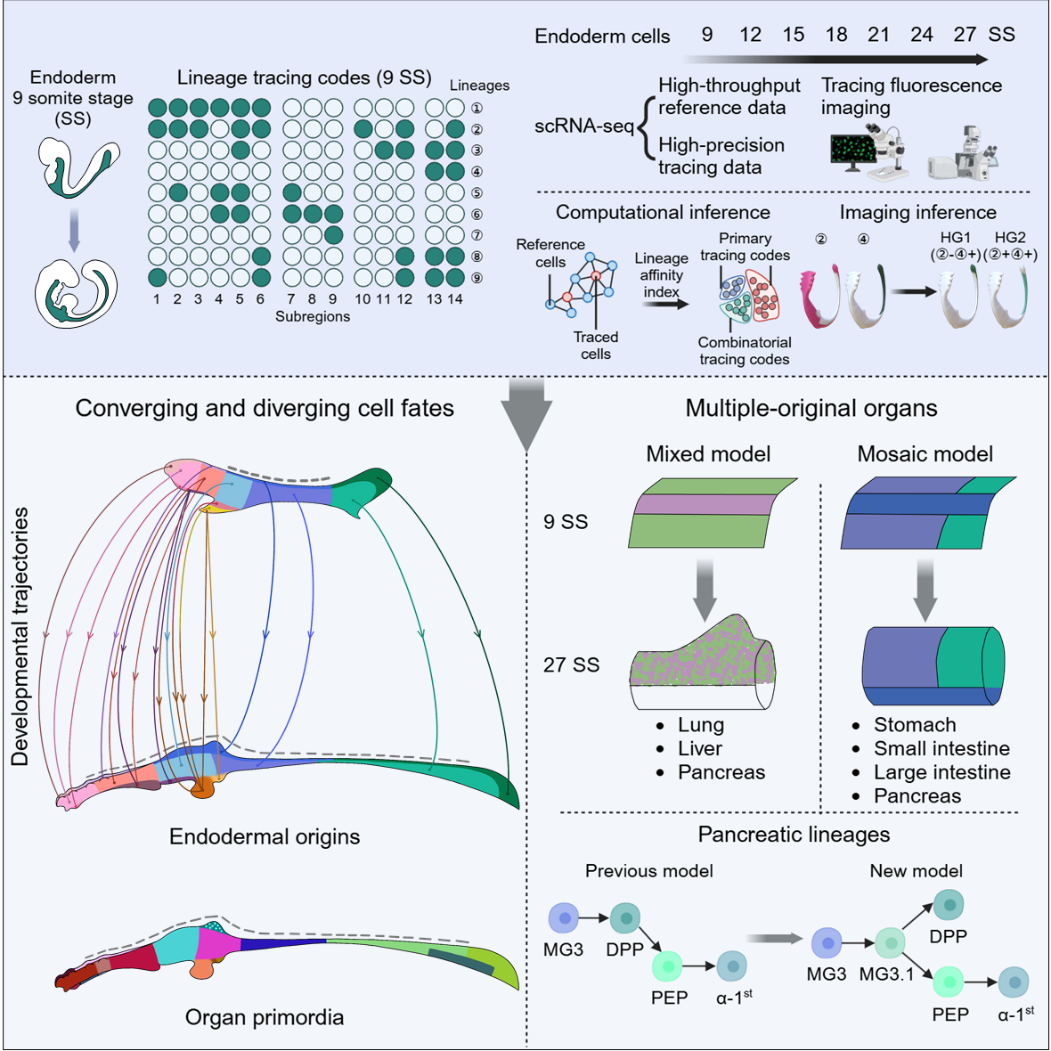
图4 内胚层器官发生的摘要图
研究意义与展望
该研究全面绘制了内胚层器官发生的时空轨迹,提出了混合型和拼接型两种器官空间分布模式,为经典的细胞分化模型提供了全新视角。这些发现不仅为发育生物学领域的基础理论研究奠定了坚实基础,还为 再生医学中的器官再造以及高级类器官模型的开发提供了重要参考。
该研究由北京大学基础医学院教授、生命科学联合中心研究员徐成冉担任通讯作者。共同第一作者包括北京大学基础医学院博士生李可冉、八年制本科生余佩隆以及前沿交叉学科研究院PTN项目博士生郑奇棋。此外,北京大学生命科学学院博士毕业生王信、基础医学院人体解剖与组织胚胎学系方璇博士和李林宸博士也为该研究做出了重要贡献。该研究得到了国家自然科学基金、国家重点研发计划及北大-清华生命科学联合中心的资助。
原文链接:https://www.cell.com/cell/abstract/S0092-8674(24)01425-9

