学院新闻
Theranostics丨冼勋德课题组利用拟人化仓鼠模型发现ApoA5缺陷导致NAFLD新机制

2024年2月24日,北京大学基础医学院冼勋德课题组在THERANOSTICS杂志上发表了题为“Depletion of ApoA5 aggravates spontaneous and diet-induced nonalcoholic fatty liver disease by reducing hepatic NR1D1 in hamsters”的文章。该研究选择脂代谢模式与人类更为接近的叙利亚金黄地鼠,通过基因编辑技术CRISPR/Cas9构建出完美模拟了人群中ApoA5突变患者严重高甘油三酯血症的基因工程仓鼠模型。该研究发现ApoA5可通过结合核转录因子NR1D1的mRNA维持其稳定性而调控肝脏脂质合成和非酒精性脂肪肝发展的新机制。
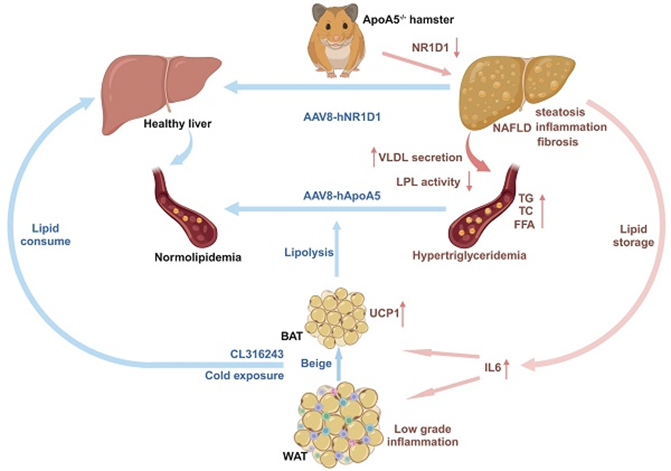
ApoA5主要由肝脏合成,虽然较其他载脂蛋白相比较,其含量极低,但却是脂蛋白脂酶LPL的主要激活因子之一。临床大数据显示,在ApoA5缺陷或失功能突变所致的高甘油三酯血症(HTG)患者中,血浆TG水平基本维持在2000mg/dL,甚至能高达20000 mg/dL。然而早期在小鼠研究发现,ApoA5缺失仅能让血浆TG升高2-4倍升高,不超过400 mg/dL,无法完全模拟人群中ApoA5突变患者的HTG。流行病学研究表明,HTG是动脉粥样硬化性心血管疾病(ASCVD)及非酒精性脂肪性肝病(NAFLD)的危险因素之一。受限于小鼠模型,ApoA5在NAFLD和ASCVD中的作用一直未得到完全清晰的研究,急需一种更适合的动物模型研究ApoA5在调控HTG及相关代谢性疾病中的作用。
本研究中构建的ApoA5敲除仓鼠模型血浆TG水平达到2500 mg/dL以上,完美模拟了人群中ApoA5突变患者的HTG。该研究结果显示,ApoA5缺失会部分引起LPL活性降低,引发TG脂解减少与肝脏脂质合成分泌增多,进而导致HTG和脂肪肝。结合肝脏转录组学分析发现,ApoA5可能通过调控核转录因子NR1D1的稳定性调节肝脏中脂质合成和NAFLD发展。通过肝脏特异性AAV8基因疗法通过基因疗法或者药物治疗与物理治疗来激活脂肪组织均可改善ApoA5缺失引起的病理表型。总之,该研究开发出一种新型的严重高甘油三酯血症的优秀动物模型,利用该模型深入理解了ApoA5作为新型的核调控因子在高甘油三酯血症,非酒精性脂肪肝和动脉粥样硬化中的保护作用,并以多角度的形式为临床上防治ApoA5缺陷所致的代谢性疾病提供了全新的视角。
该研究的第一完成单位为北京大学基础医学院。北京大学心血管研究所冼勋德研究员和黄薇副教授为本文共同通讯作者。博士生郭家宝,博士后苗国琳和博士生张文茜为本文共同第一作者。本研究得到心血管心研究所刘国庆教授的帮助,受到国家自然科学基金委的资助和血管稳态与重构全国重点实验室(北京大学)的大力支持。
原文链接:https://www.thno.org/v14p2036.htm

