学院新闻
基础医学院郑乐民团队发现巨噬细胞加重血管内皮损伤新机制
2020年11月1日北京大学心血管所郑乐民团队在氧化应激领域国际知名杂志Redox Biology(IF=9.99)在线发表了题为《p38α in Macrophages Aggravates Arterial Endothelium Injury by Releasing IL-6 through phosphorylating Megakaryocytic Leukemia 1》的研究论文,报道了巨噬细胞中p38α可通过磷酸化MKL1释放IL-6加重血管内皮损伤的发现。
经皮腔内冠脉治疗是冠心病的主要治疗方法,但是置入支架和球囊扩张等操作均会引起血管内皮损伤和再狭窄。促进血管尽快地再内皮化是有效降低血管再狭窄和冠脉疾病发生,以及预防动脉粥样硬化发生的重要环节。巨噬细胞是动脉硬化过程中的重要参与成分。它不仅参与促炎反应,而且通过分泌抗炎细胞因子从而参与炎症的消退和组织修复。p38丝裂原激活的蛋白激酶(MAPK)被多种细胞外应激和细胞因子激活。有大量证据表明p38 MAPK是炎症反应和动脉粥样硬化的潜在介质。尽管已经在巨噬细胞中对p38α进行了广泛研究,但其在巨噬细胞调节受损血管修复中的作用仍不清楚。

团队在小鼠的巨噬细胞中特异性敲除了p38α,观察到体内导丝拉伤实验中再内皮化的加速,以及利用巨噬细胞条件培养基所培养的内皮细胞在体外实验中促进增殖和迁移的过程。进而通过对炎症因子的检测,观察到炎症因子白介素6(IL-6)在p38α敲除后的下降。团队进一步探究p38α影响IL-6的机制,发现了p38α作为磷酸酶可以磷酸化转录辅助因子巨核细胞白血病因子1(MKL1),也称为心肌相关转录因子A(MRTFA),并且特异性磷酸化小鼠MKL1的S544/T545/S549位点。该位点的磷酸化是MKL1辅助NF-κB通路转录的重要位点。
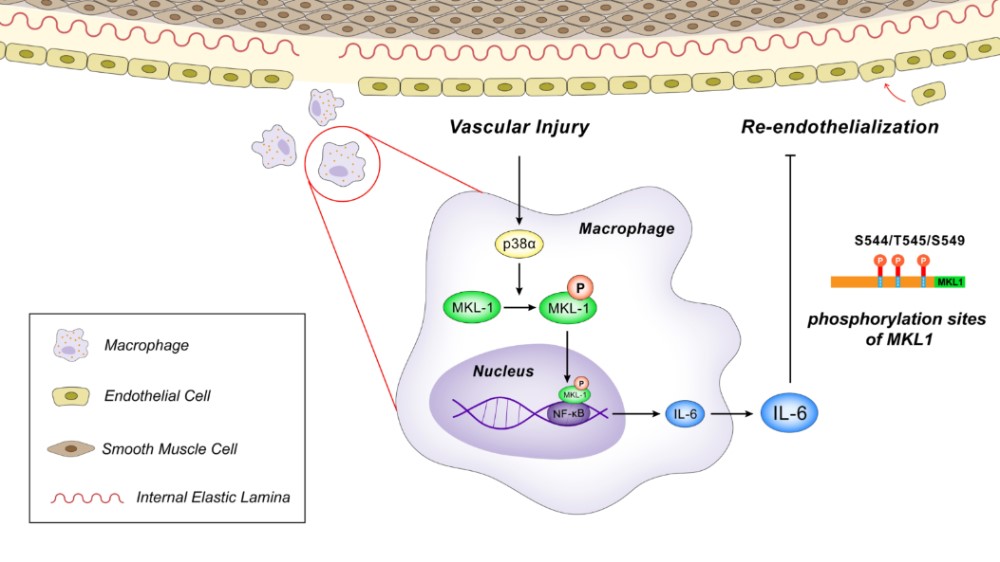
本研究为血管再内皮化提供了潜在的位点,为动脉粥样硬化的机制研究中提供了新思路。实验室期待未来在动脉粥样硬化的机制与治疗上取得更大突破。基础医学院硕士生张萌、博士生高佳宁为此文共同第一作者,郑乐民研究员为此文通讯作者。该工作得到了国家自然基金的资助。
原文链接:https://authors.elsevier.com/sd/article/S2213-2317(20)30980-0

