学院新闻
AdvancedScience|尹玉新团队报道肿瘤相关单核细胞对T细胞重编程用于肿瘤免疫治疗的新策略
目前,T细胞过继治疗(Adoptive T cell therapy,ACT)已经广泛应用于多种血液肿瘤并取得了巨大进展。然而,由于T细胞功能受损、活化不足以及持久性差等原因,T细胞过继治疗在大多数实体瘤中仍然效果欠佳。与免疫检查点阻断疗法不同,T细胞过继治疗需要T细胞在体外活化和扩增,以产生足够数量的功能性T细胞。研究表明,在T细胞体外活化时诱导其向记忆状态分化可以提高T细胞在体内的持久性并增强抗肿瘤效果。因此,优化T细胞的体外培养方法,研究如何维持T细胞的低分化状态从而提高记忆T细胞的比例,有助于拓展T细胞过继治疗的临床适用性。
近日,北京大学基础医学院系统生物医学研究所尹玉新教授团队在知名期刊AdvancedScience上发表了题为Tumor-associated Monocytes Reprogram CD8+ T Cells into Central Memory-like Cells with Potent Antitumor Effects的文章,首次阐明了肿瘤相关单核细胞可以诱导活化CD8+T细胞向中央型记忆样T细胞分化,从而增强T细胞过继治疗的效果。

在肿瘤微环境中浸润着大量肿瘤相关髓系细胞,它们通常表现出较大的异质性和复杂性,能够通过多种途径影响肿瘤的发生发展,然而其对T细胞分化的影响尚未系统性阐明。本研究利用多种荷瘤小鼠模型和癌症病人样本,发现在T细胞活化和抗原再次刺激时,肿瘤相关单核细胞(Tumor-associated monocyte,TAMo)能够促进中央型记忆T细胞(Central memory T cells,TCM cells)的产生。通过转录组学和表观遗传组学分析,研究者阐明肿瘤相关单核细胞可以对T细胞表达谱进行重塑,在限制T细胞效应功能和耗竭状态的同时赋予T细胞中央型记忆相关表型。
由于肿瘤相关单核细胞可以释放一氧化氮抑制T细胞增殖,研究者使用一氧化氮合酶抑制剂L-NMMA来解除肿瘤相关单核细胞对T细胞的增殖抑制,并发现这一处理不改变肿瘤相关单核细胞对T细胞记忆状态的影响。体外T细胞杀伤实验显示肿瘤相关单核细胞和L-NMMA处理可以提高T细胞清除肿瘤的能力。为了评估肿瘤相关单核细胞对体内T细胞介导的抗肿瘤免疫应答的影响,研究者对荷瘤小鼠进行T细胞过继治疗。结果显示,肿瘤相关单核细胞和L-NMMA双重处理的T细胞在过继转移后表现出持久性的提升和记忆功能的增强,从而显著抑制小鼠肿瘤生长。此外,肿瘤相关单核细胞还能逆转T细胞的耗竭状态,抑制终末耗竭T细胞的产生。
后续的机制研究表明,肿瘤相关单核细胞对中央型记忆T细胞分化的促进作用依赖于细胞间直接接触,并由细胞表面膜蛋白CD300LG参与介导。同时,单细胞转录组测序结果显示,肿瘤相关单核细胞由7个亚群组成,它们之间表现出转录特征和分化阶段的异质性。其中,处于终末分化阶段且高水平表达CD300LG的亚群表现出更强的诱导中央型记忆T细胞分化的能力,这进一步印证了CD300LG在肿瘤相关单核细胞调节T细胞分化功能中的作用。
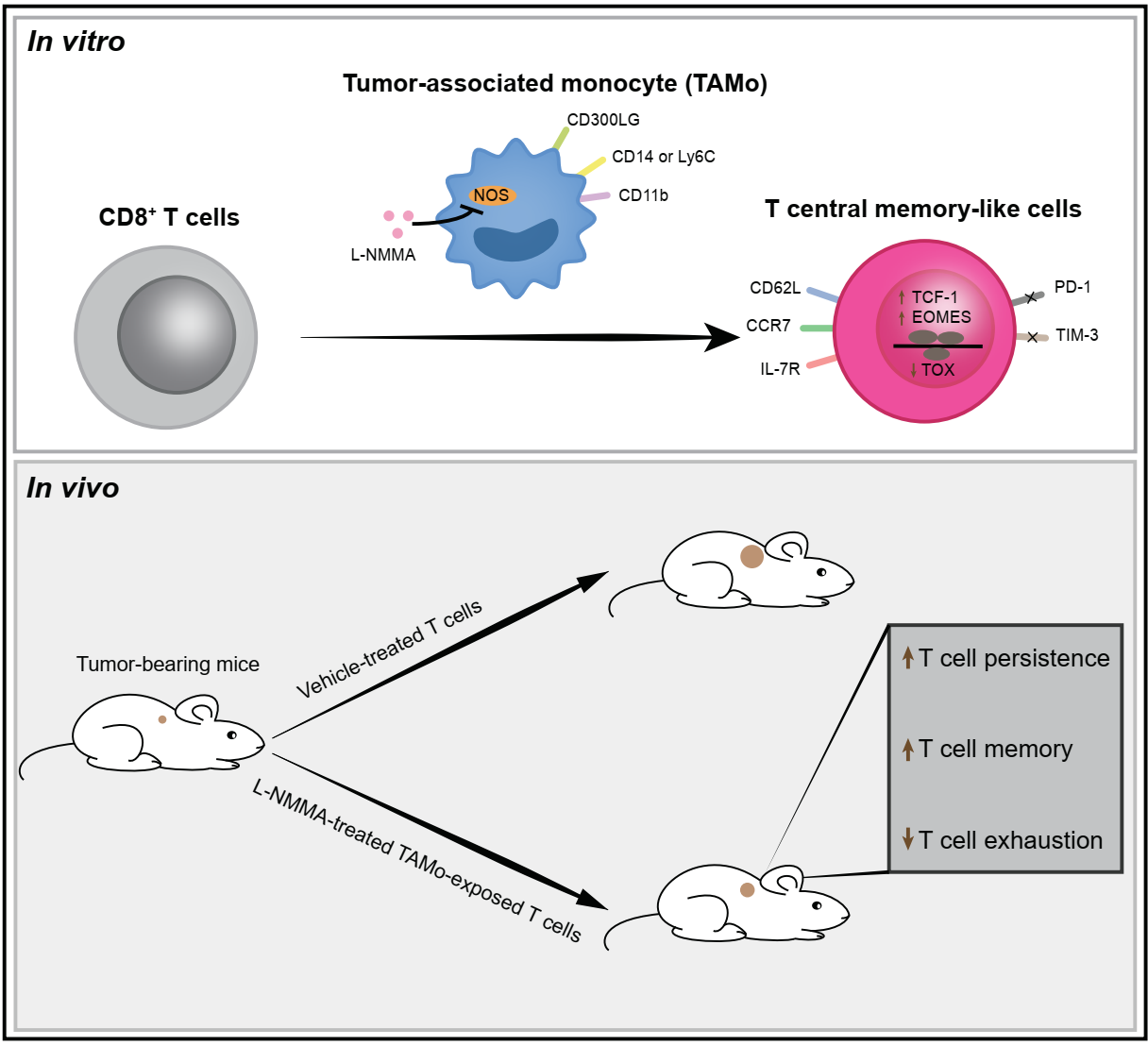
肿瘤相关单核细胞诱导中央型记忆T细胞分化从而提升T细胞过继治疗效果
综上所述,本研究首次系统性阐明了肿瘤相关单核细胞通过CD300LG诱导中央型记忆T细胞分化的新功能,提出了一种基于肿瘤相关单核细胞的T细胞过继治疗改善策略。该研究证明肿瘤微环境中不同免疫细胞存在复杂的沟通网络,拓宽了人们对肿瘤相关单核细胞功能多样性的认识,并为改善T细胞过继治疗提供了新靶点。
北京大学系统生物医学研究所尹玉新教授为该文章的通讯作者。北京大学基础医学院博士研究生杨泽亮为该论文的第一作者。
该研究得到国家重点研发计划、国家自然科学基金以及北大-清华生命科学联合中心的支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202304501

