学院新闻
Adv Sci丨鲁凤民/陈香梅/王麟团队揭示趋化因子CXCL2抑制肝癌进展的新机制
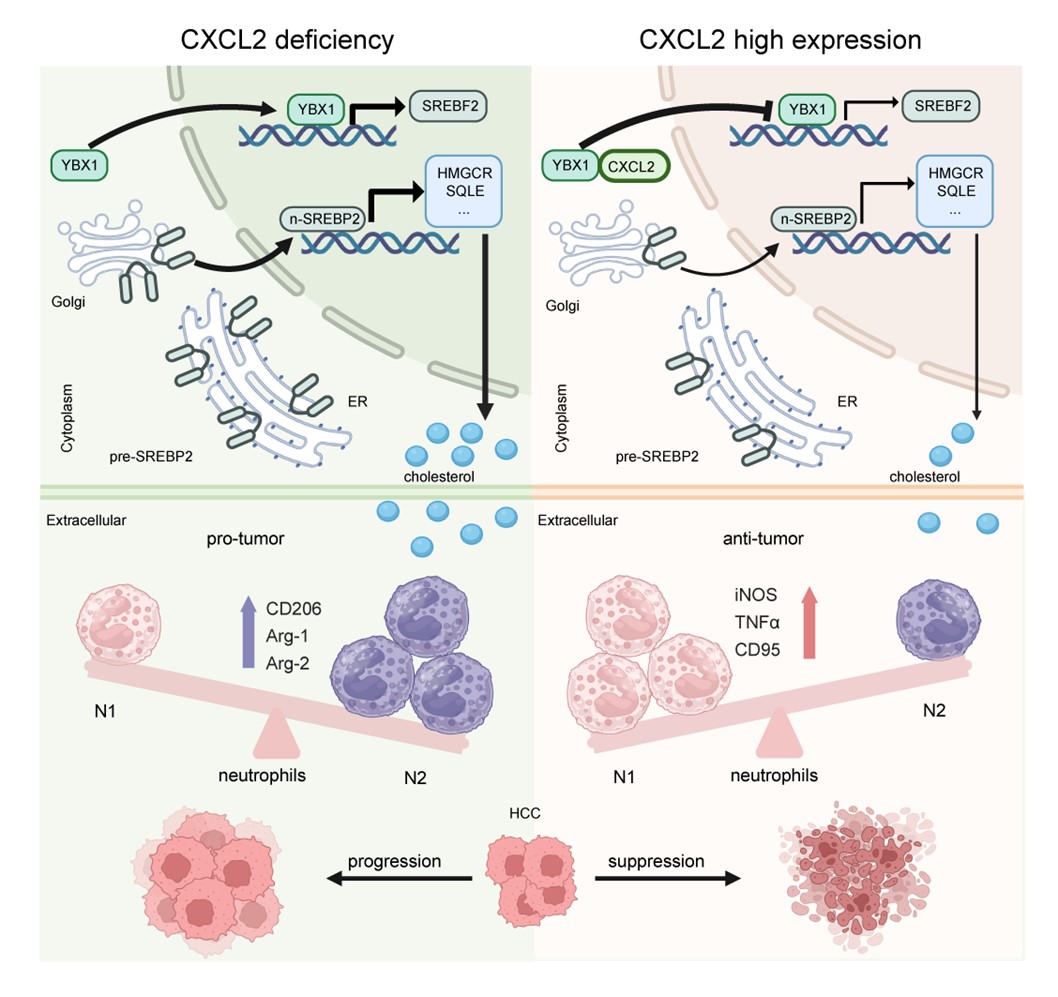
2025年10月20日,北京大学基础医学院、北京大学感染病研究中心鲁凤民/陈香梅/王麟研究团队在ADVANCED SCIENCE杂志在线发表题为“Tumor Cell-Derived CXCL2 Potentiates Neutrophil-Mediated Antitumor Immunity by Inhibiting Cholesterol Biosynthesis in Hepatocellular Carcinoma”的研究论文。不同于当前认为CXCL2主要作为趋化因子在细胞外发挥招募中性粒细胞功能的观点,该研究发现,肝癌细胞胞内分布的CXCL2可结合转录因子YBX1并抑制其核易位,后者降低了SREBF2的转录活性,抑制胆固醇生物合成,最终促进中性粒细胞的抗肿瘤作用,并可与PD-1单抗发挥协同抗HCC作用。

肝细胞癌(HCC)是导致全球癌症相关死亡的主要疾病之一。尽管免疫疗法在抗肿瘤治疗中已证实有效,但由于肝癌存在极度免疫抑制的微环境,相当比例的患者未能从现有免疫治疗方案中获益。因此,寻找调控肝癌免疫微环境的关键基因、制定新型有效治疗策略,成为当前肝癌研究领域的迫切需求。
该研究通过对课题组前期肝癌组织aCGH及RNA-seq数据的再挖掘,发现CXCL2的基因拷贝数在HCC组织中频繁缺失,并导致其低表达。进一步临床数据分析显示,CXCL2低表达患者临床预后较差。通过体内外实验,研究团队证实CXCL2不仅能发挥传统趋化因子功能、招募中性粒细胞,还可促进中性粒细胞向抗肿瘤表型(N1)极化,从而抑制HCC进展。这一发现与大多数既往研究相悖—已有报道指出肿瘤中高表达的CXCL2可通过招募中性粒细胞形成免疫抑制微环境。后续的机制探索发现,作为典型的分泌蛋白,CXCL2除了分泌至细胞外发挥趋化功能外,肝癌细胞内的CXCL2还能与转录因子YBX1相互作用,阻止其核易位,进而抑制SREBF2的转录表达,最终通过降低胆固醇合成、重塑中性粒细胞抗肿瘤表型来延缓HCC进展。此外,CXCL2过表达和PD-1单抗联合治疗可显著抑制HCC进展。综上,该研究揭示了CXCL2在调控中性粒细胞极化和HCC免疫应答中的非经典功能,为其作为潜在HCC治疗靶点提供了理论依据。
病原生物学系博士研究生刘新和青年教师杨丹丽为论文的共同第一作者。病原生物学系鲁凤民教授、陈香梅研究员和王麟研究员为论文的共同通讯作者。该研究获得了国家重点研发计划和国家自然科学基金等项目的资助,并得到已出站博士后李蒙和病原生物学系魏国超研究员的帮助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202511436

