学院新闻
Circulation Research | 周菁课题组与合作者发现基质刚度通过盘状结构域受体1(DDR1)的“液-液”相分离机制抑制Hippo通路
动脉硬化在慢性肾病患者中普遍存在,其发生率和严重程度与心血管危险因素密切相关,包括年龄、高血压、糖尿病和高脂血症等。细胞外基质(ECM)刚度可影响血管平滑肌细胞(VSMCs)的表型和行为。ECM硬化会导致VSMC过度增殖、迁移,并从收缩表型向合成表型转化。然而,细胞是如何感知ECM刚度的改变,并将力学信号转化成生物学信号,这一问题仍有待深入研究。
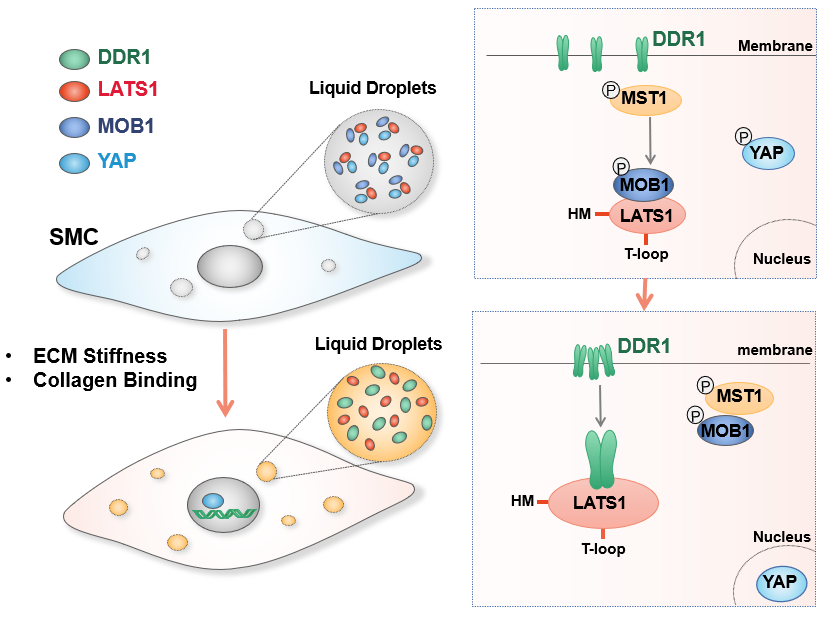
2022年12月8日,北京大学医学部基础医学院生理学与病理生理学系周菁课题组与天津医科大学基础医学院王晓虹教授等合作在Circulation Research杂志上在线发表了题为LLPS of DDR1 Counteracts the Hippo Pathway to Orchestrate Arterial Stiffening的研究论文。该研究发现ECM刚度/胶原刺激下的DDR1发生了“液-液”相分离(LLPS),并与Hippo通路的核心激酶LATS1形成共凝聚物,从而抑制了LATS1对YAP的磷酸化,导致YAP的入核和下游靶基因的激活。

此项研究中,研究者通过在体外采用不同基质刚度的水凝胶模型,体内采用5/6肾切诱导的慢性血管硬化模型,证实了DDR1可以介导血管刚度诱导的YAP活化。通过活细胞成像,荧光漂白恢复,体外相分离,免疫共沉淀以及GST-pull down等技术,此研究揭示了DDR1在胶原或基质刚度刺激下与LATS1发生共同相分离以抑制Hippo通路激活的分子机制。活化的DDR1与LATS1形成共凝聚物,竞争性地抑制了MOB1-LATS1的结合,从而导致LATS1去磷酸化和YAP活化。这是首个证明LLPS在介导血管疾病中作用的研究,证明了DDR1-LATS1-YAP轴在VSMC机械信号转导中的中心作用,并提供了抗动脉硬化的潜在治疗靶点。
图:基质刚度诱导VSMCs中DDR1-LATS1共凝聚物的形成和YAP入核
北京大学基础医学院博士生刘佳钰和王谨为本文的共同第一作者。北京大学基础医学院周菁教授和天津医科大王晓虹教授为为本文的共同通讯作者。本研究得到了国家自然科学基金重大研究计划集成项目、创新研究群体和面上项目等经费支持。周菁课题组长期从事血管稳态和疾病的力学调控机制研究,研究结果发表在在Proc. Nat. Acad. Sci. USA、Bioactive Materials、Advanced Science、Circ Res.等学术期刊。
全文链接:https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.122.322113