学院新闻
Circulation Research | 孔炜课题组&孙金鹏课题组合作揭示细胞外基质蛋白Nidogen-2抑制血管钙化的新机制

2022年11年10日,北京大学基础医学院生理学与病理生理学系孔炜教授与孙金鹏教授合作在国际知名心血管杂志《Circulation Research》上在线发表了题为“Nidogen-2 is a Novel Endogenous Ligand of LGR4 to Inhibit Vascular Calcification”的研究论文,揭示了细胞外基质蛋白Nidogen-2作为LGR4的一种新型内源性偏向性配体抑制血管钙化的新机制。
血管钙化被公认为心血管疾病发病率和死亡率的独立危险因素。尽管阐明血管钙化的分子机制调控方面取得了相当大的进展,但其病理过程的复杂性阻碍了潜在治疗方法的发展,血管钙化仍然是一个棘手的问题。巢蛋白2(Nidogen-2)是基底膜的重要组成之一,近期研究发现它对于维持血管平滑肌的收缩表型至关重要,但是其在血管钙化中的作用尚未被证实。
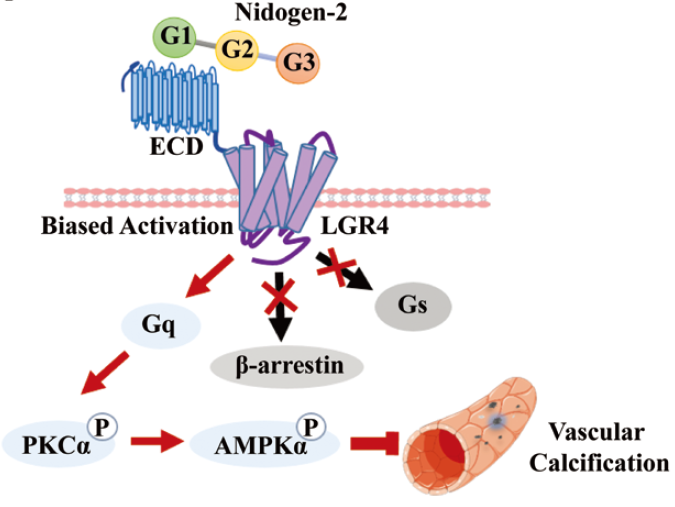
该研究通过三种小鼠主动脉钙化模型以及体外高磷诱导的血管平滑肌细胞钙化模型,发现Nidogen-2在钙化时表达显著下调。Nidogen-2缺陷小鼠主动脉钙化水平显著加重,提示Nidogen-2具有抑制血管钙化发生与发展的保护作用。蛋白质相互作用组学分析以及体内验证实验筛选出Nidogen-2潜在的结合蛋白LGR4。LGR4是一种G蛋白偶联受体,被认为是成骨细胞和破骨细胞分化的关键调节因子。通过免疫共沉淀,流式细胞结合实验和表面等离子共振结合实验,证实Nidogen-2与LGR4之间以26.77 nM的亲和力结合。有趣的是,Nidogen-2并不影响LGR4下游已知的Wnt和Gs信号,而是选择性激活Gαq-PKCα-AMPKα1信号,说明Nidogen-2是LGR4的一种新型内源性偏向性配体。体内和体外实验进一步证实,Nidogen-2作为血管平滑肌细胞响应各种钙化因子作用的内源性保护因子,通过LGR4-Gαq-PKCα-AMPKα1通路抑制血管钙化。本研究不仅拓宽了我们对细胞外基质如何微妙调节血管钙化的理解,而且阐明了一种未被重视但又至关重要的机制,即生理条件下内源性选择性激动剂对G蛋白偶联受体的偏向性调控。
北京大学基础医学院陈雨菲博士与毛晨峰博士为本文的共同第一作者。北京大学基础医学院孔炜教授、孙金鹏教授和毛晨峰博士为本文的共同通讯作者。该工作还得到了罗剑教授,张炜真教授等的支持。该项研究获得国家自然科学基金创新群体、国家自然科学基金重点项目和国家重点研发计划等资助。
原文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.122.321614
(北京大学基础医学院)

