学院新闻
Sci Adv | 基础医学院柏林/云彩红与北医三院乔杰/杭婧合作揭示棘白菌素抗真菌药物靶点1,3-β-葡聚糖合成酶的作用机制
2023年9月13日,北京大学基础医学院柏林研究员和云彩红教授与北医三院乔杰院士和杭婧副研究员合作在Science Advances杂志在线发表了题为Structure of a fungal 1,3-β-glucan synthase的研究论文。该研究解析了真菌1,3-β-葡聚糖合成酶Fks1的冷冻电镜结构,揭示了其催化合成并跨膜转运1,3-β-葡聚糖的作用机制,以及临床棘白菌素耐药突变的机制,为靶向1,3-β-葡聚糖合成酶的新型抗真菌药物研发提供了结构基础。
近年来,真菌感染相关疾病在全世界范围内越来越严重。据统计,约有300多种病原真菌可引起人类疾病,每年感染3亿人左右,导致约160万人死亡。与人体细胞不同,真菌具有细胞壁结构,并且细胞壁对于真菌的生存能力、致病性和毒力至关重要。因此,真菌细胞壁相关组分的合成酶是抗真菌药物的热门靶点。1,3-β-葡聚糖是真菌细胞壁的主要组成部分,由位于细胞质膜上的膜整合蛋白1,3-β-葡聚糖合成酶(Glucan synthase, GS)催化合成。真菌GS的催化活性主要由Fks1行使,并且受到Rho1的调节。GS在细胞内利用UDP-葡萄糖为糖基供体催化合成β-1,3-糖苷键连接的葡萄糖残基多聚糖链,同时将生成的糖链从细胞内分泌到细胞外,参与细胞壁的组成(图1a)。截至目前,已有多种以GS为作用靶点的抗真菌感染药物获得批准应用在临床治疗上,其中包括棘白菌素类和三萜类药物(图1b-c)。
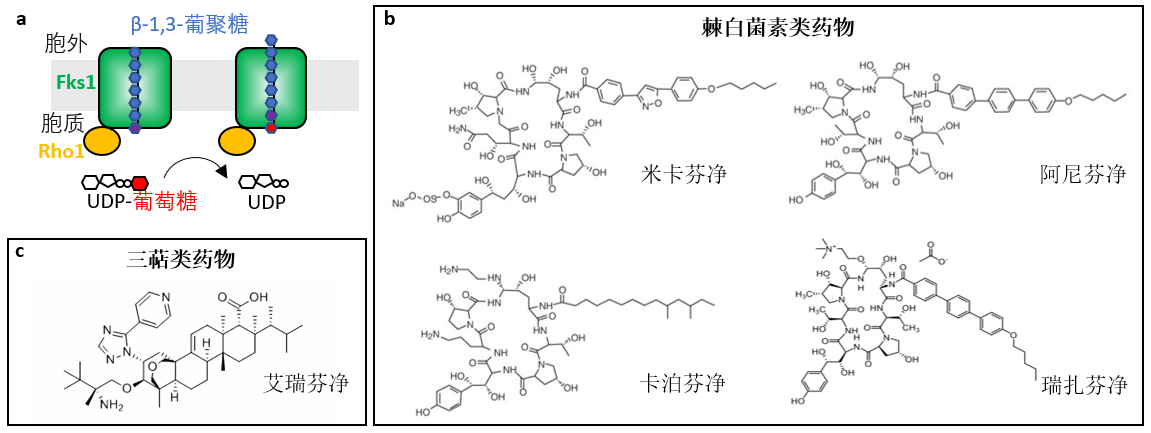
图1. β-1,3-葡聚糖合成酶作用模型与临床靶向GS的抗真菌药物
该研究利用冷冻电镜解析了真菌Fks1在2.47 Å分辨率的三维结构(图2),发现其具有和纤维素合成酶类似的核心催化结构域,并结合功能实验识别了活性位点的多个保守关键氨基酸,提示了Fks1可能的葡聚糖合成催化机制。该研究还发现Fks1的糖基转移酶结构域与C末端结构域具有相向移动的构象柔性,可能有助于活性位点的开关。此外,该研究所解析的Fks1结构显示葡聚糖转运通道处于关闭状态,通道的打开可能需要TM8的构象变化;而临床棘白菌素耐药突变主要集中于组成转运通道的TM5/6/8,提示棘白菌素可能通过影响葡聚糖转运发挥功能。最后,研究者还发现Fks1胞外区有两个保守的二硫键对其功能十分重要。
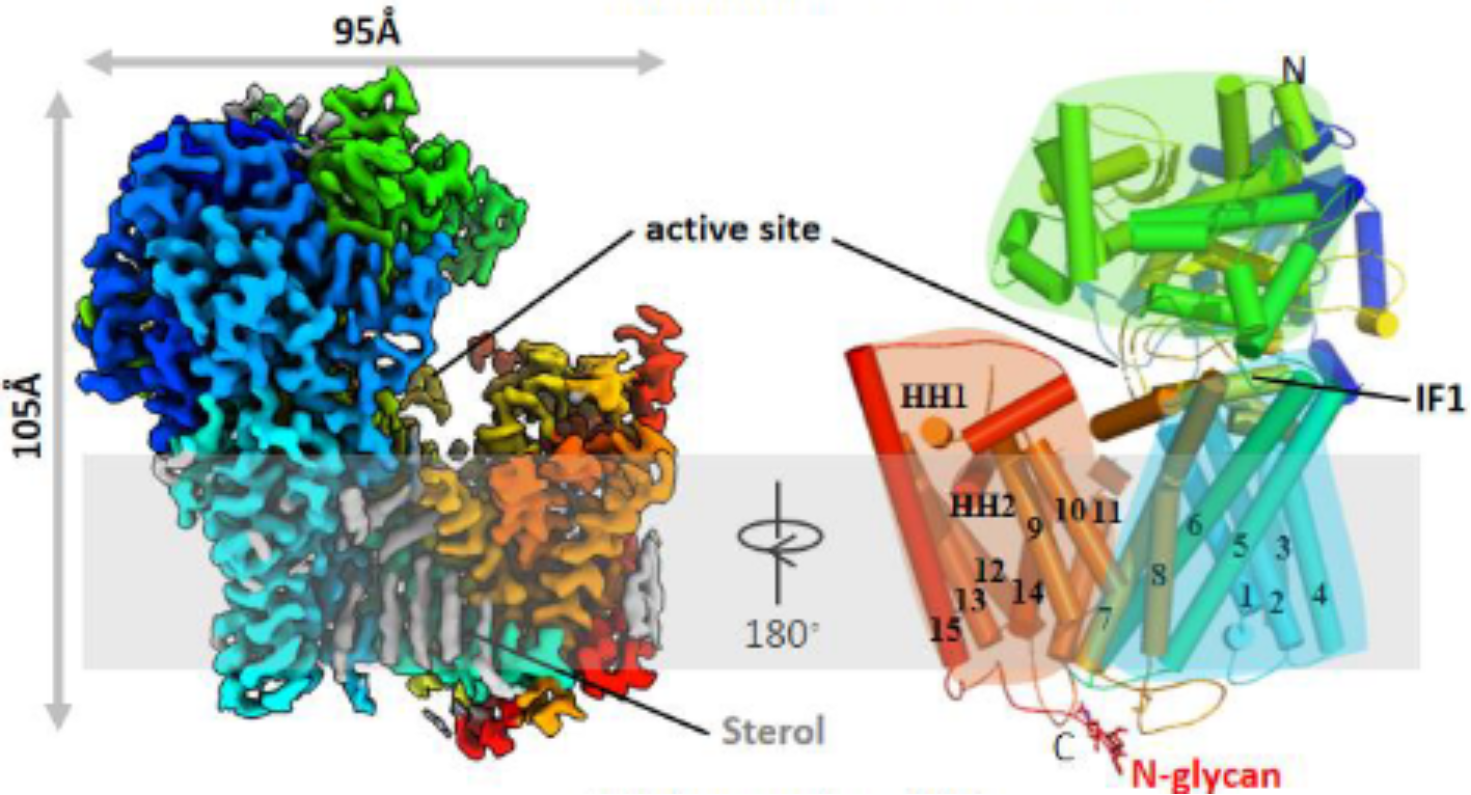
图2. β-1,3-葡聚糖合成酶的电镜密度图与三维结构模型
该研究揭示了真菌1,3-β-葡聚糖合成酶催化合成并跨膜转运1,3-β-葡聚糖的作用机制,以及临床棘白菌素耐药突变的机制,为靶向1,3-β-葡聚糖合成酶的新型抗真菌药物研发提供了结构基础。
北京大学基础医学院柏林研究员与云彩红教授、北京大学第三医院乔杰院士与杭婧副研究员是本研究论文的共同通讯作者。北京大学基础医学院赵超然博士、2021级博士研究生游子龙、陈丹丹博士及北医三院杭婧副研究员为本文的共同第一作者,北京大学基础医学院博士研究生王昭彬、季萌、王乐瑄、以及博士后赵鹏为本研究做出了重大贡献。
柏林课题组主要利用冷冻电镜等生物化学与生物物理学方法研究抗真菌药物靶点的结构与功能以及基于结构的药物研发,在Nature、Nat. Struct. Mol. Biol.、Nat.Commun.和Proc. Nat. Acad. Sci. USA等期刊发表论文数十篇。本研究得到了国家自然科学基金、海外优秀青年基金、北京大学科研启动基金等经费资助。
原文链接:http://www.science.org/doi/10.1126/sciadv.adh7820

