学院新闻
尹玉新等团队发现糖脂代谢调控的新体系
糖尿病影响全球超过 4 亿人,是一个巨大的公共卫生负担。肥胖是糖尿病患病的主要风险因素,会导致通常在糖尿病之前出现的胰岛素抵抗。目前,全基因组关联研究 (GWAS) 已经确定了 80 多个糖尿病易感位点, 而且已经在单基因形式的糖尿病中发现了越来越多的突变和变体,例如,青年成人型糖尿病 (MODY) 样糖尿病等。确定糖尿病的遗传因素有助于增进对这种疾病的病因和发病机制的认识,可以对早期预防及对症干预治疗提供强有力的支持。
泛素-蛋白酶体依赖的蛋白质降解过程是调控细胞内蛋白质水平的主要途径。 该过程由泛素连接酶介导的底物蛋白泛素化和去泛素化酶介导的底物蛋白去泛素化调控,蛋白质的泛素化和去泛素化过程构成蛋白质新陈代谢的动态平衡。目前已经鉴定出的泛素连接酶有1000多种,然而去泛素化酶只有100多种,提示每个去泛素化酶有着广谱的底物,参与多种生命过程。在既往研究中,已报道去泛素化酶OTU家族蛋白在肿瘤细胞凋亡与耐药中起关键作用,然而对其在能量代谢中的作用尚不清楚。
2022年6月7日,北京大学基础医学院尹玉新教授团队和山东第一医科大学附属省立医院宋勇峰教授团队合作在Cell Metabolism发表了题为Deubiquitinase OTUD3 regulates metabolism homeostasis in response to nutritional stresses的研究论文,揭示了去泛素酶体系统感知葡萄糖和脂肪酸等代谢信号,调控能量代谢的新机制。该研究阐述了去泛素化酶OTUD3动态传递葡萄糖/脂肪酸等代谢信号入核并维持能量代谢稳态的过程,其研究成果可为肥胖和糖尿病发病机理研究提供方向性指导,为制定有效预防和治疗措施提供理论依据。
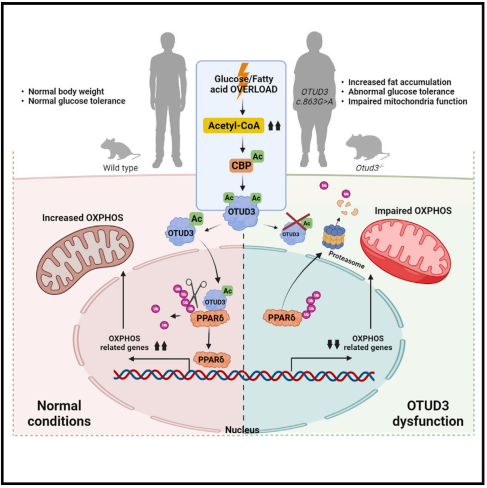
研究团队发现一个具有类似青少年发病的成人型糖尿病 (MODY) 特征的糖尿病家系,但基因组全外显子测序没有检出已知与MODY相关的致病基因突变,提示该家系可能由新的致病基因引起。进一步研究发现该家系中糖尿病患者携带OTUD3 c.863G>A突变,其编码蛋白OTUD3是OTU去泛素化酶家族成员。
实验研究发现OTUD3 c.863G>A突变可以大幅降低OTUD3的去泛素化酶活性以及蛋白自身稳定性。为证明该基因是否与MODY遗传性糖尿病发病相关,团队构建了Otud3基因敲除小鼠,研究显示Otud3基因敲除小鼠出现代谢紊乱及高脂饮食诱导的肥胖形成胰岛素抵抗等糖尿病早期特征,表明OTUD3的去泛素化酶功能缺失会引起肥胖并增加糖尿病发生风险。进一步研究证实,OTUD3可感知机体的能量状态,动态调整在细胞质和细胞核中的分布,进而维持能量平衡,从而抑制肥胖发生。机制探索表明,在葡萄糖或脂肪酸刺激下,乙酰转移酶CBP感知糖脂代谢产生的乙酰辅酶A将OTUD3乙酰化,促使OTUD3转运入细胞核,切除以PPARδ为代表的多种与能量代谢相关的转录因子的泛素链,减缓这些转录因子的降解,延长其发挥功效的时间,以此维持细胞能量代谢的活性。然而当OTUD3功能出现障碍时,以PPARδ为代表的多种与能量代谢相关的转录因子的稳定性降低,难以维持细胞正常的能量代谢,进而导致肥胖、糖尿病发生。此外,该团队还通过CHIP-Seq联合RNA-Seq实验鉴定了OTUD3可能调控的转录因子,验证了去泛素化酶调控多个具有类似功能的底物并发挥强大的功能。同时将经典的去泛素化酶调控底物蛋白的稳定性拓宽到基因调控层面。
综上所述,这项研究发现新的与肥胖及糖尿病发病相关的关键致病基因OTUD3,揭示了OTUD3蛋白功能相关的新的能量代谢调控机制,为寻找肥胖及糖尿病的潜在治疗靶点提供了新的线索。
北京大学基础医学院博士后/山东第一医科大学附属省立医院临床医学检验部周娜博士,北京大学前沿交叉学科研究院齐海龙博士和山东第一医科大学附属省立医院刘俊君副研究员为文章共同第一作者。北京大学基础医学院尹玉新教授和山东第一医科大学附属省立医院宋勇峰教授为共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金重点项目以及北大-清华生命科学联合中心的支持。
原文链接:https://doi.org/10.1016/j.cmet.2022.05.005
(北京大学基础医学院)