学院新闻
周菁团队发表血流剪切力调控的血管内皮细胞向平滑肌细胞信号传递的机制研究成果
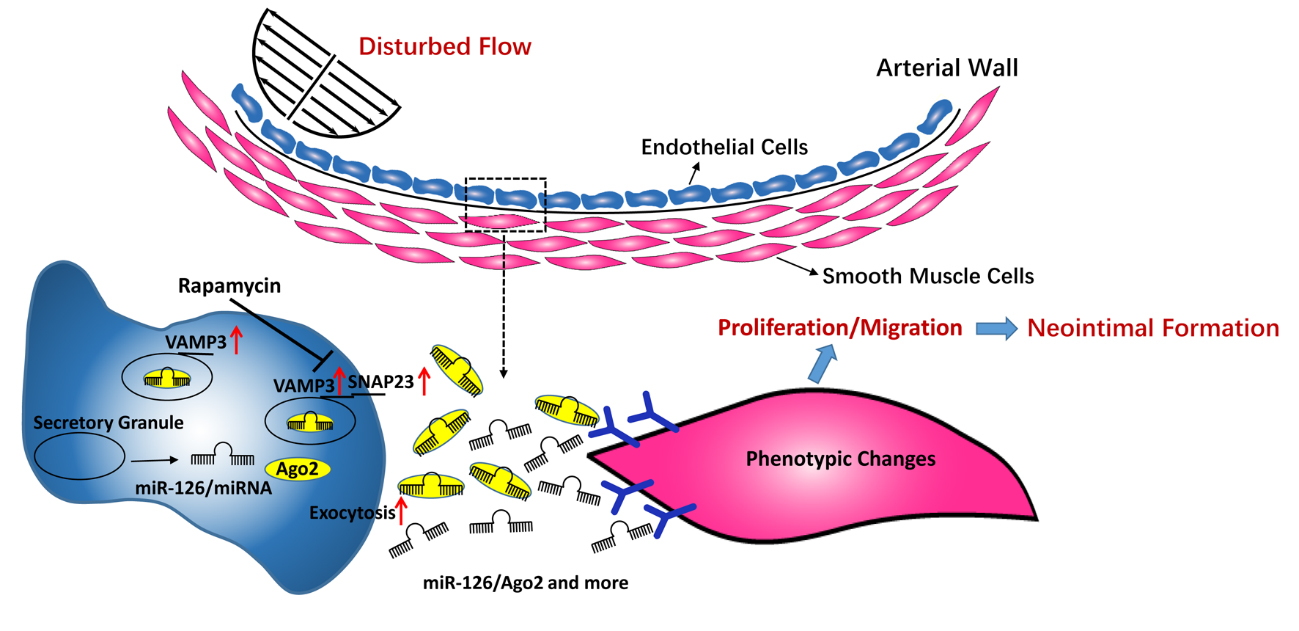
内皮细胞SNARE蛋白VAMP3和SNAP23介导剪切力调控的microRNA分泌
2017年7月17日,北京大学基础医学院周菁研究员团队与美国加州大学圣迭戈分校钱煦教授团队合作在《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America)在线发表题为《VAMP3 and SNAP23 mediate the disturbed flow-induced endothelial microRNA secretion and smooth muscle hyperplasia》的研究论文,首次报道了内皮细胞SNAREs蛋白在促动脉粥样硬化的血流剪切力所致血管平滑肌细胞增殖、迁移和新生内膜形成中的重要作用。周菁研究员团队的2014级博士研究生朱娟娟和2011级八年制博士研究生刘跃峰为该研究论文的共同第一作者。
临床医学证据显示早期动脉粥样硬化斑块少发于动脉的主干直部,而好发于血管的弯曲或分歧处,如主动脉弓、颈动脉和肾主动脉的分歧处。因为这些弯曲、分岔、和开口部位的血液流动特别复杂,其所产生的扰流(disturbed flow)引起的振荡型低剪力(oscillatory and low shear)是改变血管稳态、诱导血管重构、从而促进动脉粥样硬化发生的重要因子。扰流持续作用于内皮细胞,引起内皮下平滑肌细胞由高度分化的收缩表型向迁移、增殖的合成表型转化,表现出新生内膜形成、血管管径变窄,促进早期动脉粥样硬化发生。血流剪切力并不直接作用于平滑肌细胞,它是如何通过内皮细胞调控平滑肌细胞功能的机制有待阐明。周菁研究员的前期研究发现:扰流剪切力促进内皮细胞分泌微小RNA(miRNA)与Ago2蛋白的复合物(miR-126-3p/Ago2),这些复合物可被平滑肌细胞摄取并导致平滑肌细胞功能异常;而对血管具有保护作用的层流剪切力则能抑制内皮细胞miR-126-3p/Ago2的分泌(Zhou J et al. Circulation Research, 2013)。然而剪切力调控内皮细胞微小RNA分泌的机制尚不清楚。
利用体外流体剪切力加载模型、共培养合并流体加载模型、小鼠血流扰流模型等研究系统,结合胞外miRNA组学方法,周菁研究员团队进一步发现:保护血管的层流和损伤血管的扰流可差异性地调控15个miRNA的分泌(P < 0.05),其中上、下调倍数大于2的miRNA有11个;不同流场剪切力对内皮细胞miRNA分泌的调控是通过对可溶性N-乙基马来酰亚胺敏感的融合蛋白附着蛋白受体SNARE复合物中VAMP3和SNAP23这两个蛋白的表达和转位调控来实现的;在内皮细胞中敲低VAMP3和SNAP23可抑制扰流对与内皮细胞共培养的平滑肌细胞的增殖、迁移和表型转换的诱导;mTOR抑制剂Rapamycin能抑制VAMP3与SNAP23在静态和剪切力作用下的生物合成;内皮细胞分泌的miR-126-3p可促进平滑肌细胞增殖和去分化表型、促进小鼠颈总动脉新生内膜增厚,而抑制VAMP3和SNAP23则能将这些改变逆转或减弱。研究结果确认了胞外miRNA在血流动力学调控的血管病理生理过程中的作用,增进了对血流剪切力调控的血管内皮细胞向平滑肌细胞信号传递的机制以及动脉硬化发生机制的了解,并提出VAMP3与SNAP23有成为相关血管疾病早期诊断和干预的关键靶点的可能。
该研究项目得到国家自然科学基金“血管稳态与重构”重大研究计划培育项目、基金委优秀青年科学基金项目、以及北京市自然科学基因面上项目的资助。
论文链接:http://www.pnas.org/content/early/2017/07/13/1700561114.full

