学院新闻
柏林课题组与合作者揭示真菌质膜质子ATP酶的底物转运机制
2021年11月8日,北京大学基础医学院柏林课题组在Nature Communications杂志在线发表了题为Structure and activation mechanism of the hexameric plasma membrane H+-ATPase的研究论文(https://doi.org/10.1038/s41467-021-26782-y)。该研究解析了自抑制(3.2 Å)和激活状态(3.8 Å)的酿酒酵母质膜H+-ATPase(Pma1)六聚体的冷冻电镜结构,揭示了其从抑制到激活的构象变化和转运H+的分子机制,为基于质子泵的广谱抗真菌药物研发提供了结构基础。
细胞膜上的电化学梯度是多种基本生物过程的基础,包括为营养物质或阳离子跨膜运输提供能量,帮助离子通道信号转导等。哺乳动物细胞主要依赖于Na+/K+-ATPase维持膜电势,而真菌和植物则依赖质膜H+-ATPase维持膜上质子和电势梯度。由于其功能重要性和种属特异性,质膜H+-ATPase也被认为是广谱抗真菌药物研发的重要靶点。质膜H+-ATPase属于P型ATP酶的3A亚家族(P3A-ATPase),在正常生理条件下处于自抑制状态,在低pH条件下激活,利用ATP水解磷酸化提供能量来驱动H+从胞内向胞外主动运输,从而保持胞质pH稳定。不同于其他P型ATP酶,质膜H+-ATPase很可能以独特的六聚体结构发挥功能。质膜H+-ATPase六聚体的自抑制、激活以及转运质子的分子机制都还不清楚。
该研究显示内源纯化的Pma1呈六聚体状态,其C端尾巴(C-tail)在自抑制与激活调控中发挥重要作用。在自抑制状态时,C-tail中的helix-i介导了两个相邻Pma1分子P结构域的相互作用;而在激活状态时,该helix-i呈现无序状态,使得P结构域可以自由变构,从而催化底物转运。这些结构也很好的解释了C-tail磷酸化会阻碍helix-i与P结构域的结合从而使H+-ATPase保持激活状态。有意思的是,柏林课题组还发现Pma1六聚体圆环中间嵌入了50多个有序排列的脂质分子,为六聚体结构提供支撑作用,很可能与酵母细胞膜隔间结构MCP的功能相关。此外,该研究还显示Pma1六聚体中一个单体从自抑制到激活状态下的构象变化会推动相邻单体的激活,进而导致所有六个Pma1单基的激活。这种all-or-none激活机制可能更有效率的转运H+,加快酵母对环境变化的反应,确保快速生长。柏林课题组还结合之前报道的突变体活性研究,通过结构分析和比对识别了Pma1的底物转运通道与关键氨基酸,揭示了其质子转运的结构生物学基础。
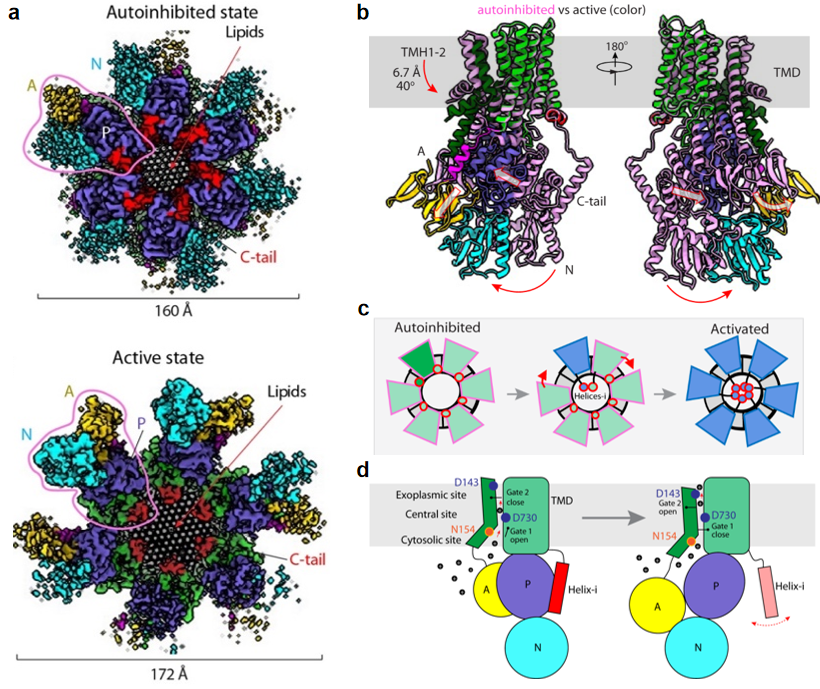
图1. 真菌质膜质子ATP酶六聚体的自抑制、激活和质子转运机制
北京大学基础医学院柏林研究员与Van Andel研究所Huilin Li教授是本研究论文的共同通讯作者。北京大学基础医学院赵鹏博士和博士研究生赵超然为本文的共同第一作者,北京大学基础医学院博士研究生陈丹丹和云彩红教授为本研究做出了重大贡献。柏林课题组和Huilin Li课题组在过去几年里合作研究报道了多种P型ATP酶的作用机制(Nat. Commun.,2019;ELife,2020;Nat. Commun.,2021),本工作是针对P型ATP酶家族结构与功能研究的又一进展。柏林课题组主要利用冷冻电镜等生物化学与生物物理学方法研究重要疾病相关膜蛋白的结构与功能,研究方向包括真菌药物靶点和P型ATP酶等,在Nature、Nat. Struct. Mol. Biol.、Nat.Commun.和Proc. Nat. Acad. Sci. USA等期刊发表论文数十篇。柏林课题组长期招聘博士后和联合培养学生,感兴趣者请联系lbai@bjmu.edu.cn。
原文链接:https://www.nature.com/articles/s41467-021-26782-y
(基础医学院)

