学院新闻
张宏权/战军团队发现AMPK-HOXB9-KRAS轴感知细胞能量变化调控肺腺癌进程的新机制
肺癌所致死亡率位于所有恶性肿瘤之首,严重影响人类生存和健康。一个世纪前德国科学家Warburg观察到肿瘤特有的代谢变化特点,即 “Warburg effect”,这种高糖低氧的代谢状态影响肿瘤的进展。研究表明,二型糖尿病的一线首选药二甲双胍有抑制“Warburg effect”,减缓肿瘤进程的作用,但具体机制还不完全清楚。
2022年8月23日,北京大学基础医学院、北京大学国际癌症研究院张宏权/战军团队在Cell Reports杂志上在线发表了题目为The AMPK–HOXB9–KRAS Axis Regulates Lung Adenocarcinoma Growth in Response to Cellular Energy Alterations的研究论文。该研究报道了在发育和肿瘤发生发展过程中均发挥重要功能的转录因子HOXB9的两种新翻译后修饰 — 磷酸化和泛素化:调控能量代谢的核心激酶AMPK介导HOXB9 T133位点的磷酸化;E3泛素连接酶Praja2介导HOXB9 K55、K188、K194位点的泛素化。受AMPK催化的HOXB9磷酸化促进HOXB9经Praja2介导的泛素蛋白酶体途径降解,导致细胞内HOXB9蛋白水平降低和HOXB9的靶基因表达减少。该研究发现了AMPK的新底物HOXB9,揭示出磷酸化-泛素化两种翻译后修饰偶联在一起共同调控HOXB9的降解机制,阐明HOXB9通过调节癌基因Kras的表达在肺腺癌发展过程中发挥重要作用。

研究人员发现HOXB9作为一种能量传感器,通过接收葡萄糖、二甲双胍、compound C等调控AMPK激活或抑制的信号刺激,来响应对自身蛋白稳定性的调控,进而起到调控肺腺癌发展进程的作用。这一发现在AMPK基因敲除小鼠体内得到了进一步的证实:野生型小鼠在进行饥饿或者二甲双胍喂药处理后,肺组织内HOXB9蛋白水平明显降低,而在AMPK敲除的小鼠,饥饿和二甲双胍喂药都不能改变肺组织内HOXB9的蛋白水平,表明HOXB9的稳定性受控于AMPK。
KRAS是最早被发现的致癌驱动因子之一,有效抑制KRAS激活的化学药物目前已有突破,而KRAS的表达水平与其激活密切相关。研究人员通过RNA-seq、qPCR、ChIP分析及Luciferase报道基因检测等实验手段及JASPAR数据库预测等方法,发现HOXB9能够直接靶向癌基因Kras转录起始位点上游−1,000 ~ −850,从而证实Kras是HOXB9的一个新靶基因。引人关注的是,野生型和磷酸化缺失型的HOXB9对降解有抵抗,蛋白更趋稳定,与Kras基因启动子的结合及对KRAS表达的上调能力明显高于磷酸化型HOXB9。在肺腺癌患者样本中也建立了AMPK、HOXB9磷酸化与KRAS之间的序贯调控关系。
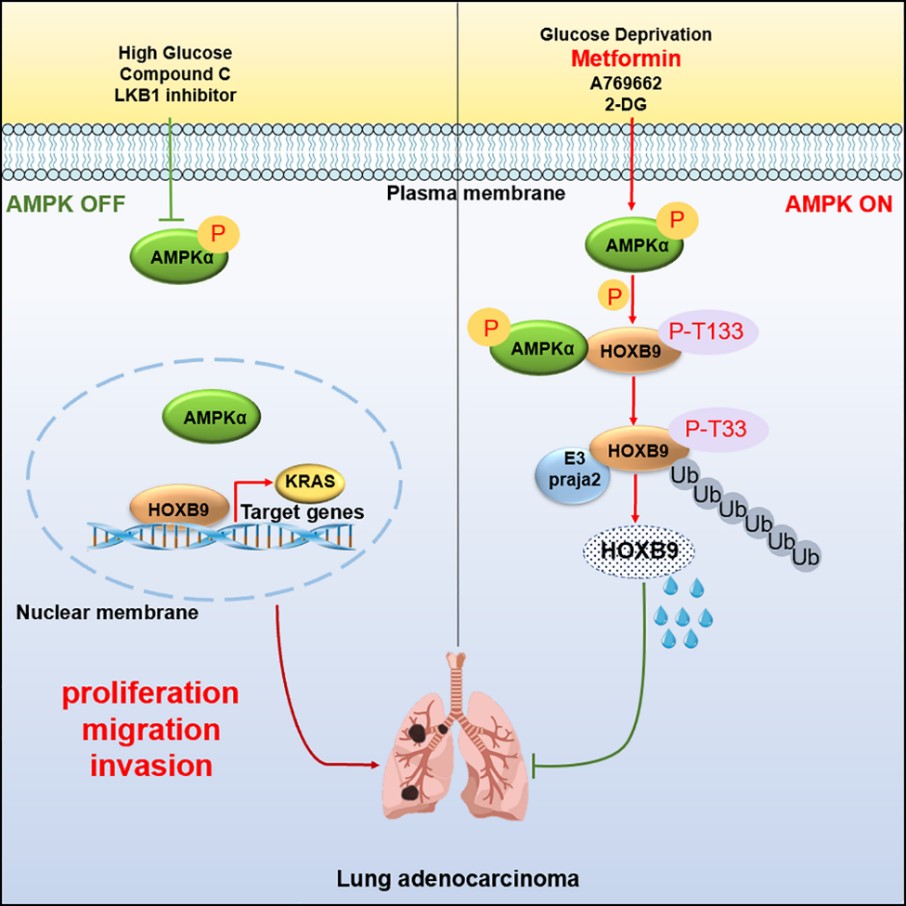
据此研究人员提出一个连接细胞能量代谢与肺癌演变进程的新模型:“AMPK-HOXB9-KRAS”调控轴调节肺腺癌的进展,从而首次以转录因子HOXB9为“纽带”将葡萄糖代谢与Kras联系在一起,为二甲双胍抗癌的作用提出了新的机制。本研究揭示的分子机制也解释了为何低糖或控糖饮食能够抑制肿瘤进展、抗氧化抗衰老和延年益寿。
北京大学基础医学院博士研究生王天卓为本文的第一作者,北京大学基础医学院、国际癌症研究院张宏权教授和战军副教授(Lead contact)为论文的通讯作者。研究过程得到了北京大学第一医院核医学科康磊副教授和李翠翠博士的帮助。该研究受国家自然科学基金重点项目、科技部重大基础研究专项、国家及北京市自然科学基金面上项目,北京大学重点基础专项及北大医学—医学+X青年专项资助。
相关论文信息:https://doi.org/10.1016/j.celrep.2022.111210

