学院新闻
EMBO Reports|吴聪颖团队报道Myo19缺失促进肿瘤微环境ROS梯度和趋化迁移
2024年1月26日,吴聪颖课题组在EMBOReports在线发表文章Loss of Myo19 increases metastasis by enhancing microenvironmental ROS gradient and chemotaxis,报道了实体肿瘤内活性氧(ROS)的特异空间分布,并揭示了其促进肿瘤细胞迁移和侵袭的机制。

实体肿瘤内的细胞往往处于活性氧积累的微环境。以H2O2形式存在的ROS已被证实能够诱导中性粒细胞的趋化迁移,但ROS在肿瘤微环境中的空间分布特征及其对肿瘤细胞趋化运动的调控作用尚未研究透彻。
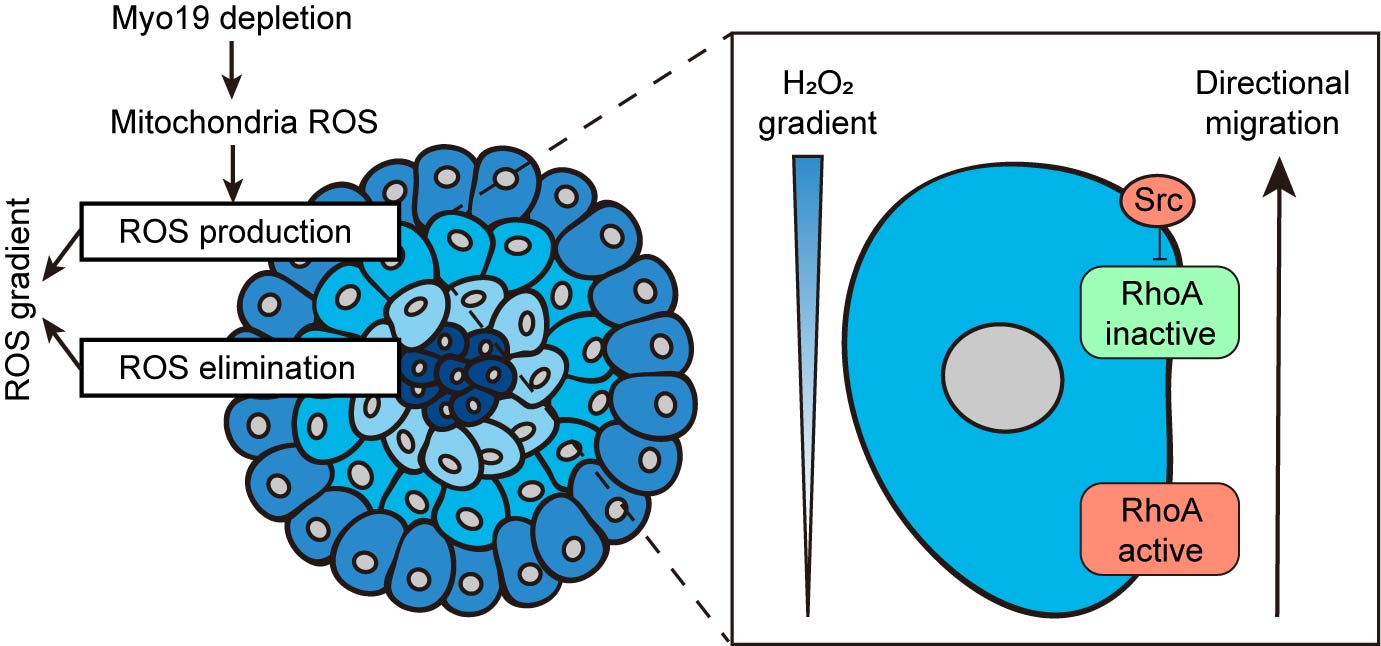
首先,作者利用3D肿瘤细胞球体系和RoGFP活性氧探针,发现肿瘤细胞球边缘,即细胞运动最活跃的区域,存在向外逐渐升高的ROS浓度梯度。在多种类型的ROS中,H2O2稳定性较高,并且能跨越细胞膜介导细胞化学信号传递。接着,利用体外细胞趋化运动装置,作者发现肿瘤细胞能够响应胞外的H2O2梯度进行趋化运动,并且这种运动模式受到Src-RhoA通路的调控。H2O2能够激活Src激酶,并抑制Rho家族小GTP酶RhoA活性。RhoA在细胞运动前端的局部抑制可能导致Myosin II活性和细胞收缩力在细胞运动后端的极性分布,为细胞定向迁移提供驱动力。
细胞ROS的主要来源之一是氧化磷酸化过程中的电子泄露,这一过程发生于线粒体内嵴。吴聪颖课题组曾于2022年在Nature Communications杂志发表论文报道线粒体定位的微丝马达Myo19能够调控线粒体内嵴结构和氧化磷酸化代谢。在该项研究中,作者发现Myo19的缺失促进了线粒体ROS的产生,并增强了肿瘤细胞球的ROS浓度梯度。进一步在小鼠肿瘤模型和临床病人样本中探究了Myo19等线粒体内嵴结构调控蛋白对于肿瘤细胞的侵袭和迁移的影响。
综上所述,该文章探究了实体肿瘤内ROS的空间分布特征及其对肿瘤细胞迁移侵袭的影响,创新性地提出了H2O2梯度诱导的肿瘤细胞趋化运动模式,并揭示了Myo19调控肿瘤ROS分布和肿瘤转移的病理意义,为肿瘤细胞侵袭转移的机制研究提供新的理论基础。
北京大学基础医学院博士研究生任小雨和博士后石鹏为论文的共同第一作者,石鹏博士也是该文章的共同通讯作者。该工作还受到北京大学基础医学院病理系苏静老师的支持与帮助,该研究受到国家重点研发计划和国家自然科学基金等经费的支持。
原文链接:https://www.embopress.org/doi/full/10.1038/s44319-023-00052-y

