学院新闻
Circ Res|基础医学院郑铭课题组在心脏纤维化调控机制研究中取得重要进展
2023年6月22日,北京大学基础医学院生理学与病理生理学系郑铭课题组在Circulation Research杂志(IF=23.213)在线发表了题为“TGF-β1/SMAD3 regulates programmed cell death 5 that suppresses cardiac fibrosis post-myocardial infarction by inhibiting HDAC3”的研究论文,揭示了PDCD5(程序性细胞死亡分子5)作为经典纤维化通路TGF-β/SMAD3的新靶点,负反馈性抑制心脏纤维化的作用及作用机制。

心脏纤维化可发生在多种心血管疾病如高血压、心肌梗死、心肌肥厚等发展过程中。例如,心肌梗死发生后,损伤区炎症细胞募集并分泌炎性细胞因子,激活肌成纤维细胞,分泌大量胶原等细胞外基质成分,对损伤的心脏组织进行瘢痕修复,引起心脏结构和分子的重塑。进行性心脏纤维化可引起心功能障碍,是心衰的独立危险因素,也是心梗后患者死亡的主要原因。因此,探索心肌梗死后心脏纤维化重塑的分子机制,将为临床抑制及治疗心梗后心脏进行性纤维化甚至心力衰竭提供新的思路和药物作用靶点。
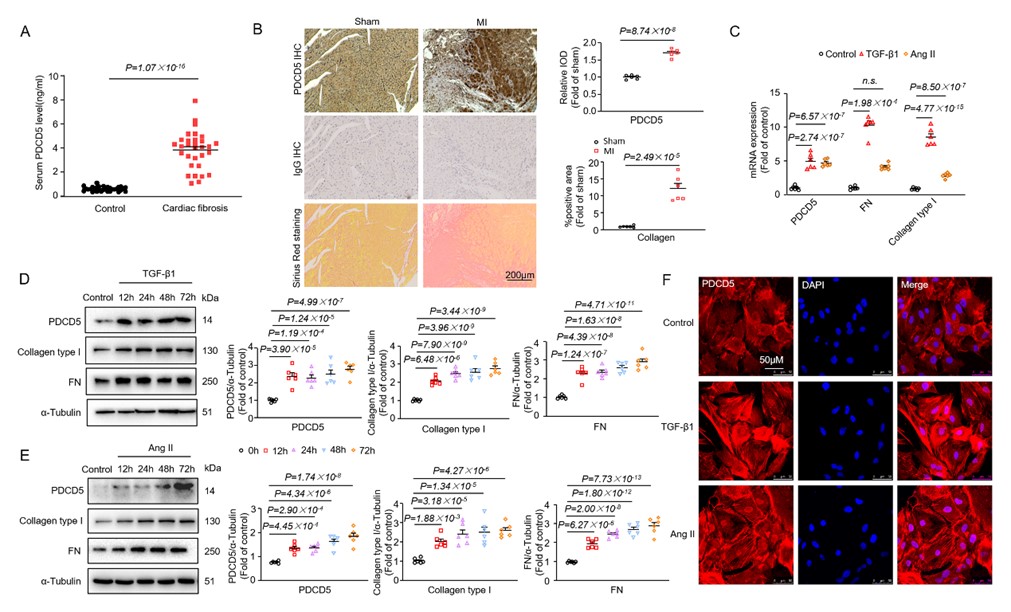
PDCD5在包括心脏在内的组织中普遍表达;该课题组前期研究发现,PDCD5在心肌肥厚时上调,通过调控心肌细胞肌浆网钙信号,负反馈性抑制心肌细胞肥大(Hypertension, 2018)。然而,PDCD5在心脏纤维化中的作用尚未可知。本研究发现,在心脏纤维化患者的血清、心梗后纤维化小鼠的心脏组织以及Ang II或TGF-β1刺激的心脏成纤维细胞中,PDCD5水平显著升高;在心脏成纤维细胞中过表达PDCD5或用PDCD5蛋白处理可降低纤维因子刺激促纤维化蛋白的表达,敲低PDCD5则增加纤维化反应。
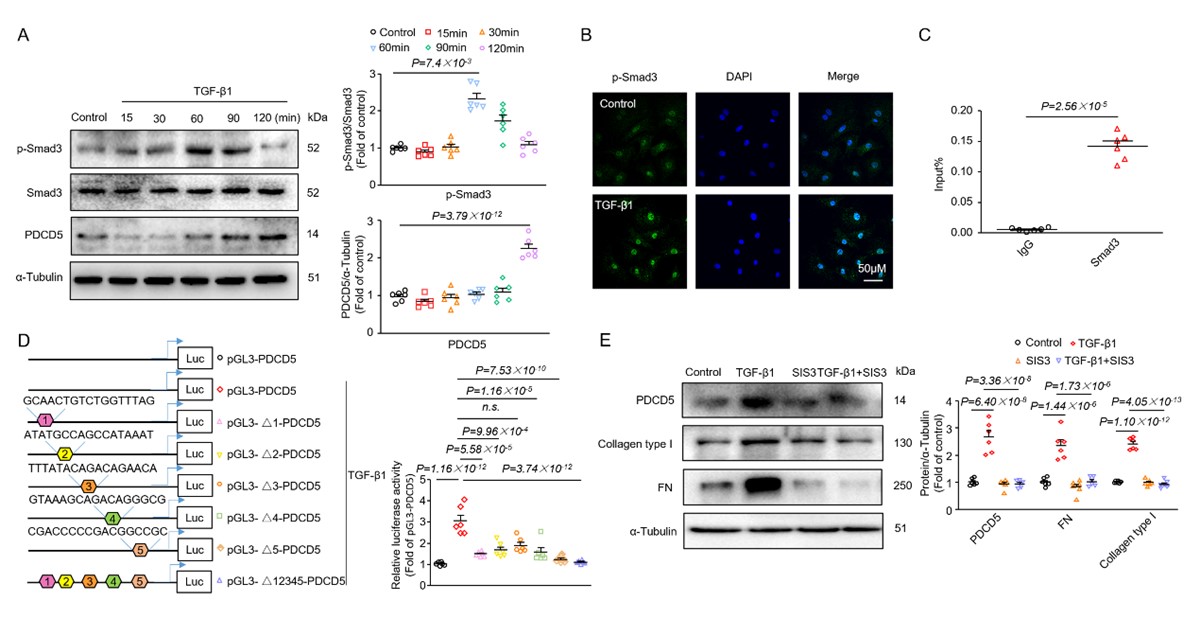
进一步探讨机制,发现纤维化通路的经典转录因子SMAD3在心脏纤维化过程中直接转录激活PDCD5;上调的PDCD5与组蛋白去乙酰化酶3 (HDAC3)相互作用并促进HDAC3泛素化降解,从而抑制心脏纤维化。
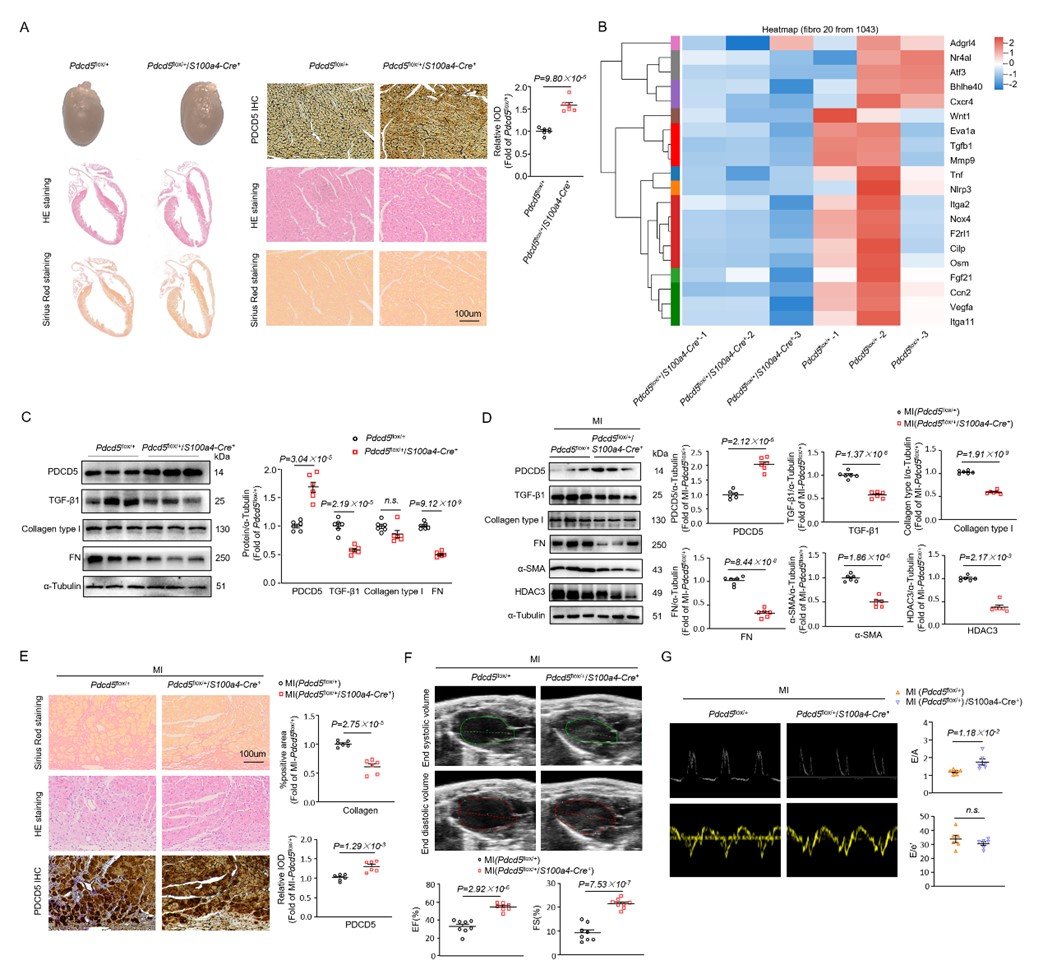
小鼠成纤维细胞特异性PDCD5基因敲入(PDCD5 knock-in)可显著改善小鼠心肌梗死后的心脏纤维化,增强心功能;而AAV9介导HDAC3过表达则可以逆转由PDCD5基因敲入所发挥的抑制小鼠心脏纤维化作用。
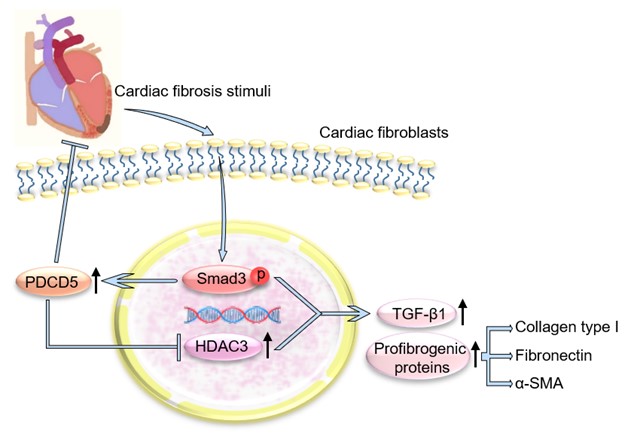
综上,该研究揭示了PDCD5是经典纤维化信号TGF-β/SMAD3的新靶点,在心梗后心脏纤维化患者和纤维化小鼠心脏中上调,并通过抑制HDAC3负反馈性干预纤维化进展。提示PDCD5是心脏纤维化的内源性稳态调节因子,在干预纤维化重塑相关的心血管疾病中具有重要的转化前景。
北京大学基础医学院生理学与病理生理学系博士后翁琳及北京大学人民医院国家创伤医学中心助理研究员叶菁菁为论文的共同第一作者,北京大学基础医学院郑铭研究员为论文的通讯作者。该论文得到国家重点研发计划及国家自然科学基金等多个项目的支持。
原文链接:https://doi.org/10.1161/CIRCRESAHA.123.322596

