学院新闻
尹长城团队揭示细胞内钙释放通道(RyR1)激活的关键机制
2025年2月24日我校基础医学院生物物理学系尹长城教授团队的论文“Structural insights into transmembrane helix S0 facilitated RyR1 channel gating by Ca2+/ATP”在NatureCommunications杂志在线发表。

该论文在离子通道领域有两方面全新发现:(1)与一般认为离子通道的6次跨膜螺旋不同,发现ryanodinereceptor(RyR)/钙释放通道多一条跨膜螺旋,为7次跨膜螺旋,研究组将该螺旋命名为S0;(2)S0螺旋为RyR/钙释放通道门控的关键部件:只有在S0螺旋与其余6个螺旋发生结构耦联,离子通道才能被激动剂(Ca2+/ATP)激活而完全开放;如果S0螺旋与其余6个螺旋解耦联,离子通道只能被激动剂(Ca2+/ATP)激活到前开放(Primed/Pre-open)状态。该研究解决了RyR/钙释放通道领域长期悬而未解之谜,为基于结构的药物设计提供了新的靶点。
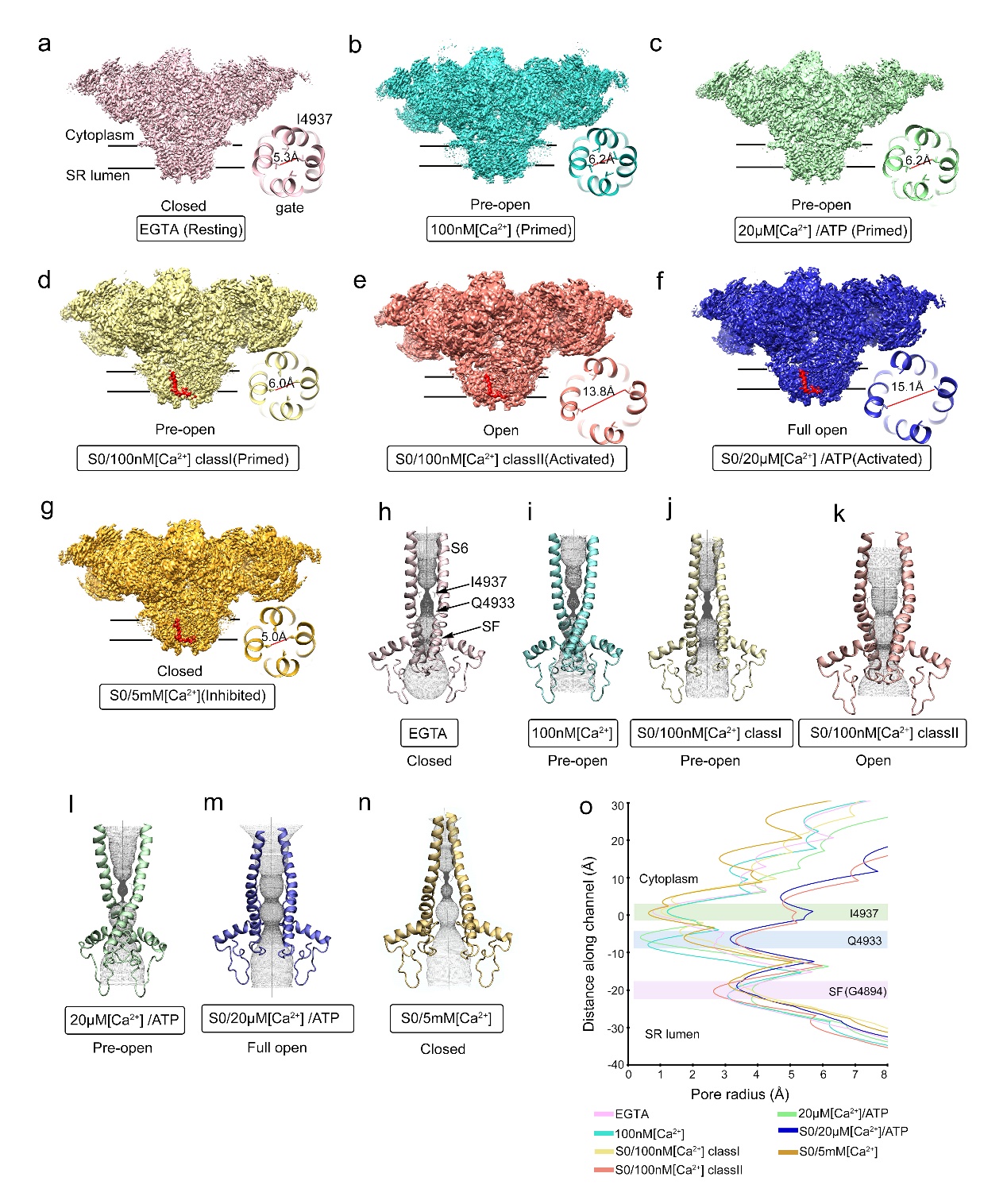
图1:本研究解析RyR1不同状态的结构。(a)为静息状态(resting);(b,c,d)为开放前状态(primed);(e,f)为开放状态(activated)和(g)抑制状态(inhibited)。(d-g)图中红色电镜密度为RyR1的S0螺旋
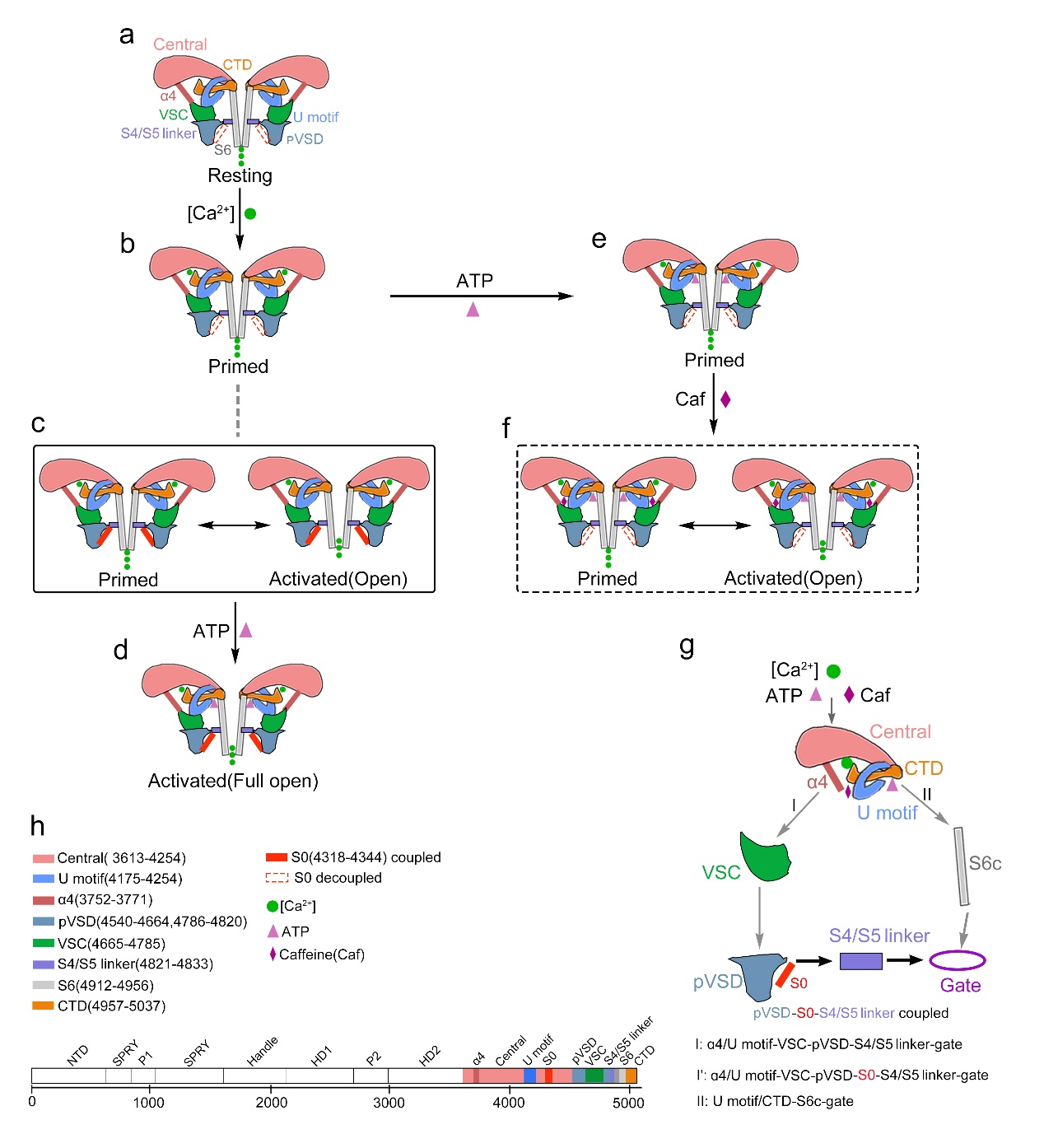
图2:Ca2+,ATP,Caffeine和S0对RyR1通道门控的卡通图,研究结果揭示S0与pVSD耦联是RyR1通道激活的关键机制
该研究与香港中文大学(深圳)胡红丽教授和华中科技大学刘闯研究员合作完成。我校基础医学院生物物理学系韦日生和香港中文大学陈强博士为共同第一作者,刘闯研究员、尹长城教授和胡红丽教授为共同责任作者,我校基础医学院生物物理学系为第一完成单位。该研究由科技部重点研发计划、国家自然基金委员会、香港中文大学等项目资助。
原文链接:https://www.nature.com/articles/s41467-025-57074-4

